Revista Canal Abierto 46 | Caso Clínico
Enfoque Perio-Mimético de Diente Endodónticamente Tratado con Severo Compromiso Estructural. Reporte de 2 casos.
Aceptado: 31-07-2022
Páginas 48-56
Claudio Melej 1,2
Cirujano Dentista, Especialista en Periodoncia U. de Chile, Mg Educación en Ciencias Médicas U. de Chile.
1 Docente Diplomado en Biomimética UDP.
2 Práctica privada clínica ABADIA, Antofagasta-Chile.
Resumen
Los dentistas deberíamos preguntarnos con frecuencia si nuestras decisiones realmente están resolviendo los problemas orales de nuestros pacientes o incluso los empeoramos con protocolos clásicos centrados en tratar sólo la lesión, sin atención en los tejidos periodontales o, como ocurre en la actualidad, con obsesiva preocupación por lo estético. Ya que pareciera que nuestro enfoque tradicional generalmente no proporciona un método eficaz para controlar o atenuar el “ciclo restaurativo”. Más bien, el tratamiento restaurador invasivo macro mecánico estándar sin enfoque biológico-preventivo ni énfasis en la preservación del sustrato y capital biológico a menudo crea problemas adicionales al comprometer estructuralmente o sobrerigidizar el diente endodónticamente tratado. El objetivo de este artículo es, a través de la exposición de dos casos clínicos, presentar un enfoque biomimético conservador no tradicional de dientes endodónticamente tratados con severo compromiso estructural y que, bajo estándares rehabilitadores clásicos, serían razonablemente considerados como “sin esperanza” o no tratables.
Palabras claves: Biomimética, Ciclo Restaurativo, Crack, Compromiso Estructural, Diente Fisurado, Endodoncia.
Abstract
We dentists should frequently ask ourselves if our decisions are really solving the oral problems of our patients or even worsening them with classic protocols focused on treating only the lesion, without attention to the periodontal tissues or, as is currently the case, with obsessive concern for the aesthetic. Since it seems that our traditional approach generally does not provide an effective method to control or attenuate the “restorative cycle”. Rather, standard micromechanical invasive restorative treatment without a biological-preventive approach or emphasis on preservation of the substrate and biological capital often creates additional problems by structurally compromising or over-stiffening the endodontically treated tooth. The objective of this article is, through the presentation of two clinical cases, to present a non-traditional conservative biomimetic approach to endodontically treated teeth with severe structural compromise and that under classical rehabilitative standards would reasonably be considered "hopeless" or untreatable.
Keywords: Biomimetics, Crack, Cracked Tooth, Endodontic Treatment, Restorative Cycle, Structural Compromise
Introdución
El diente íntegro posee un perfecto equilibrio morfológico, estructural y funcional entre los diferentes tejidos o sustratos que lo conforman [1, 2]. Con la pérdida de esmalte el diente se desrigidiza y, dependiendo del nivel de sustracción de tejido, puede llegar a perder 10 ó más veces su rigidez natural [3], incrementando significativamente su deformación flexural, riesgo de generación de cracks y de fractura patológica [1, 2, 4-6].
La cavitación dentaria genera alteraciones estructurales y desconexión cuspídea [5] que el diente no restaurado adhesivamente o sobre-rigidizado con metal y/o postes [7-10] de una u otra forma debe atenuar, compensar o subsidiar, ya sea a expensas del aumento del estrés compresivo en dentina, propagación de cracks por aumento del estrés tensil [11], mayor deformación flexural inter cuspídea [3], fractura parcial o, en casos severos, falla catastrófica irreparable [7-10].
Los tratamientos dentales invasivos estándar que se proporcionan comúnmente no abordan la necesidad de sellar, reconectar, reforzar y reconstruir el diente cavitado, procurando imitar un comportamiento lo más cercano posible al del diente íntegro [12]. De hecho, estos tratamientos generan y perpetúan frecuentemente una cadena de eventos totalmente inaceptables: El Ciclo Restaurativo [13].
En palabras de Elderton R. J. (2003): Ha llegado el momento de corregir esta iniquidad. La caries dental y las enfermedades periodontales son condiciones dinámicas que necesitan ser “manejadas” con protocolos conservadores y rigor en lo preventivo [13]. El objetivo de este reporte es, a través de la exposición de dos casos clínicos, presentar un enfoque biomimético conservador no tradicional de dientes endodónticamente tratados con severo compromiso estructural y que, bajo estándares rehabilitadores clásicos, serían razonablemente considerados como “sin esperanza” o no tratables.
Presentación del Caso Clínico
Caso 1
Paciente sexo femenino, 54 años de edad ASA 1 y de profesión dentista que en junio de 2019 comienza a experimentar en el primer molar superior derecho (1.6) dolor episódico de mediana intensidad durante la función masticatoria y ante cambios de temperatura.
Al examen tomográfico, el molar que fue obturado con una amalgama oclusal a los 9 años de edad, evidenció un rasgo de fractura en el piso cavitario a nivel de cúspide mesio-vestibular proyectado hacia la zona de furcación (fig. 1). Al realizar el retiro de la amalgama, se confirmó la presencia de un crack de extensión mesial-distal (fig. 2), optando el tratante por una resina directa como alternativa conservadora y poder controlar la evolución de la sintomatología dolorosa durante el post-operatorio inmediato.
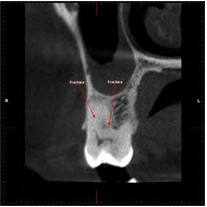
Figura 1. Imagen tomográfica 2019. Se observa rasgo de fractura en piso de cámara próximo a zona de furcación raíz mesio-vestibular.

Figura 2. Imagen clínica 2019 (fotografía proporcionada por la paciente). Se observa crack mesio distal en piso pulpar.
A los dos días, el molar fue trepanado de urgencia por presentar una pulpitis aguda de carácter irreversible. Tres especialistas declinaron realizar el tratamiento endodóntico, sugiriendo la exodoncia y posterior reemplazo por un implante osteointegrado.
Un cuarto endodoncista accedió con reparos (y sólo por razones de amistad y de cercanía laboral con la paciente) realizar la endodoncia y posterior obturación con ionómero de vidrio.
En mayo de 2022, el molar experimentó la fractura de la cúspide mesio-palatina.
Todos los colegas consultados indicaron como único tratamiento posible la extracción dental. Sin embargo, la paciente decide trasladarse más de 2000 kms desde su lugar de residencia a la ciudad de Antofagasta en busca de una última opinión conservadora bajo un protocolo periodontal-biomimético.
El autor del presente artículo, al realizar el examen clínico observó que además de la fractura ya descrita, la zona presentaba un absceso y un sondaje periodontal palatinos de más de 15mm de profundidad (fig.3). Junto con retirar el fragmento fracturado, se decidió levantar un colgajo exploratorio muco-perióstico para mejorar el acceso y visibilidad, facilitando procedimientos de preservación alveolar ante una posible extracción.

Figura 3. Imagen clínica 2019 (fotografía proporcionada por la paciente). Se observa crack mesio distal en piso pulpar.
Se determinó la presencia de una fractura longitudinal total de la raíz palatina con una extensa pérdida ósea para-radicular. Después de discutir detalles intra-operatorios y opciones con la paciente, se decidió realizar la radectomía palatina, técnica de regeneración (fig. 4) y posterior reconstrucción con protocolo adhesivo biomimético con énfasis en maximización de fuerza adhesiva, control de estrés de contracción de polimerización y protección oclusal [12, 14-17].
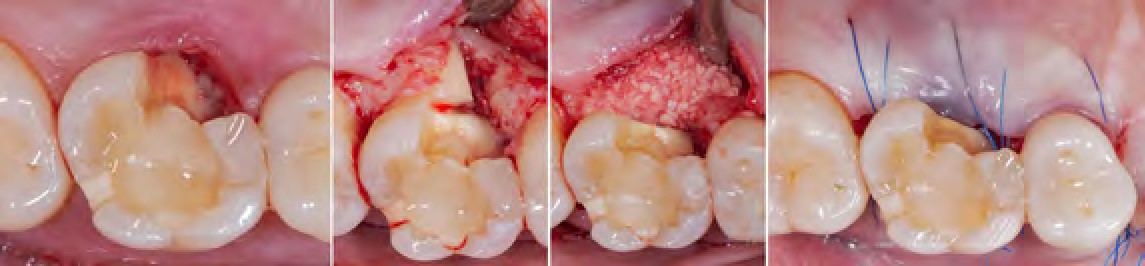
Figura 4. Secuencia de remoción fragmento coronario,
radectomía palatina y preservación alveolar.
Inmediatamente después del procedimiento quirúrgico, se aisló y retiró el resto de la restauración, quedando en evidencia el crack mesio-distal diagnosticado el año 2019 (fig. 5).
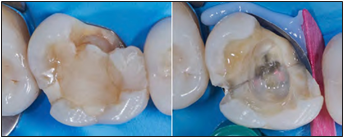
Figura 5. Crack mesiodistal.
Después de la limpieza, preparación y activación del sustrato dentario (esmalte y dentina), se eligió como sistema adhesivo y de sellado dentinario Optibond FL de Kerr-U.S.A., junto con fibras continuas Ribbond-U.S.A., para la protección de interfase adhesiva y reconexión de sustrato; junto con atenuar la generación de micro movimiento y evitar o, en su defecto, desviar la propagación de cracks (fig. 6). Para la elevación de márgenes profundos se utilizó resina de esmalte ENA HRI Biofunction de MiceriumItaly, con sistema de banda matriz Slick Band Garrison U.S.A. (fig. 7); en el reemplazo del núcleo dentinario, para favorecer la recuperación de tenacidad, se optó por la resina reforzada con fibras discontinuas EverX posterior de GC. Se finalizó con resina empacable Clearfil AP-X de Kuraray-Japón, a modo de blindaje final de la biobase (fig. 8). Como reemplazo indirecto de esmalte se utilizó una cerámica de Disilicato de Litio Emax Dentsply Sirona Alemania, en protocolo CEREC chairside y conexión adhesiva con resina ENA HRI Biofunction de Micerium termo plastificada en horno Calset de AdDent-U.S.A. (fig. 9)
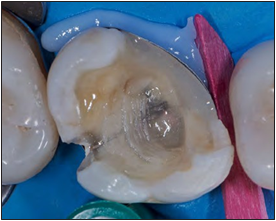
Figura 6. Técnica adhesiva, protección interfase, sellado y
reconexión.

Figura 7. Elevación de margen profundo con sistema de
matriz SlickBands de Garrison.
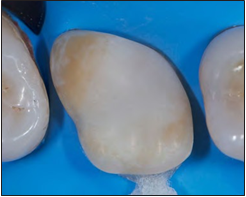
Figura 8. Biobase
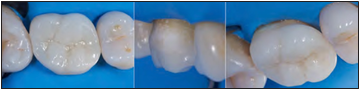
Figura 9. Conexión adhesiva.
Nota: Al momento del envío del presente artículo para revisión y publicación, se cumplieron cuatro meses desde el alta inicial. Durante este tiempo la paciente informó ausencia total de sintomatología dolorosa u otro tipo de incomodidad o alteración funcional (A los 6 meses se solicitará cone beam de control).
Caso 2
Paciente sexo femenino 80 años de edad ASA 2 (HTA controlada) es derivada en marzo de 2022 por su hija de profesión dentista. El motivo de consulta fue dolor espontáneo episódico de moderada intensidad en segundo molar superior derecho (1.7). Al examen clínico se observó una extensa reconstrucción de resina oclusomesial, cuyo tiempo de evolución fue impreciso (más de 10 años) y un sondaje periodontal distal profundo de 12 mm con una evidente proyección hacia la zona apical.
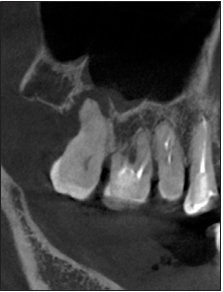
Figura 10. Corte tomográfico inicial (marzo 2022).
La hipótesis diagnóstica fue de una lesión endo-periodontal de origen (“posiblemente”) endodóntico.
Después de discutir el caso clínico con el endodoncista Dr. Marco Escudero, se acordó realizar el tratamiento de conductos como medida inmediata de alivio del dolor, prevenir un posible cuadro infeccioso agudo y recuperar calidad de vida. Complementariamente, la especialista en periodoncia Dra. Lía González J., realizó la correspondiente terapia periodontal integral no quirúrgica.
Transcurridas 24 horas de la endodoncia, la paciente manifestó un total alivio con ausencia de dolor u otro tipo de sintomatología asociada, ante lo cual se indicó recambio de restauración con protocolo adhesivo biomimético [12, 14-20].
Al remover la totalidad de la resina, bajo condiciones de aislación absoluta, quedó en evidencia una fractura distal a nivel coronario que en cámara y piso pulpar se proyectaba a modo de crack, sin separación ni desplazamiento de fragmentos, exudado, sangramiento u otro signo clínico que hiciesen sospechar una comunicación franca a periodonto (fig. 11).
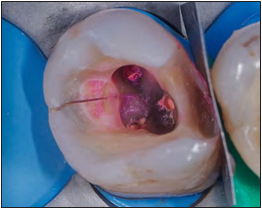
Figura 11. Fractura distal y crack en piso de cámara pulpar.
Después de informar a la paciente, enfatizando el pronóstico desfavorable y alternativas de tratamiento, se decidió intentar una opción conservadora.
El protocolo indicado fue similar al descrito para el caso 1. Sin embargo, en atención a la severidad y complejidad del compromiso estructural, se intensificaron las medidas de sellado, protección y reconexión con fibras continuas de polietileno del tipo Ribbond [20-29] (fig. 12), llegando sólo hasta la reconstrucción dentinaria o biobase sin reemplazo de esmalte, dejando contactos oclusales leves con antagonista (prótesis parcial removible de extremo libre bilateral con remanencia de grupo V). Esto último, con el objetivo de tener un período mínimo de 6 meses de evolución y control en espera de una re-evaluación imagenológica.
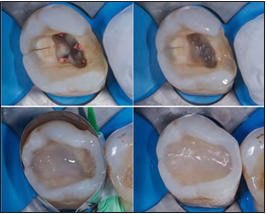
Figura 12. Protocolo adhesivo, sellado, reconexión y refuerzo
estructural.
En la radiografía control tomada en agosto de 2022 (fig. 13), se observó una imagen compatible con un proceso reparativo óseo altamente satisfactorio, lo que también fue corroborado con la reducción significativa a parámetros normales de la profundidad de sondaje. Esto último, junto a la oclusión antagónica descrita, aspectos funcionales, consideraciones generales y deseos de la paciente, inclinaron la decisión por un reemplazo directo de esmalte sin reducción ni cobertura cuspídea (fig. 14).
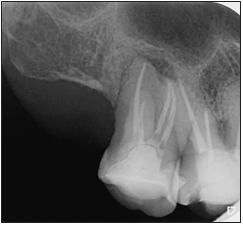
Figura 13. Control radiográfico (agosto 2022).
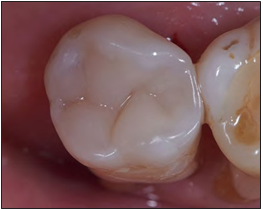
Figura 14. Reemplazo directo de esmalte.
Discusión
Los dientes sintomáticos con craks o fracturas incompletas pueden ser una gran fuente de ansiedad para el paciente y el dentista tratante, ya que los desafíos no sólo están asociados con la obtención de un diagnóstico preciso, sino también, en definir un tratamiento eficiente, eficaz y predecible en el tiempo de los casos con síndrome de diente fisurado. [30]
El factor más importante en el diagnóstico de un diente fisurado es aceptar que sí existen estas fisuras o cracks, siendo el síntoma predominante el malestar a la presión y los cambios térmicos [31]. Pero mucho más importante es entender que la principal causa que explica su generación y propagación en dentina es el compromiso estructural asociado a los procedimientos odontológicos invasivos y sistemas de reconstrucción no adhesivos con una sobre-rigidización del diente por el uso de postes y/o metales [32].
Larson en el año 1981 ya establecía con claridad y significancia la importancia de la pérdida del esmalte como un primer paso de compromiso estructural, demostrando que dientes cavitados se debilitaban significativamente respecto a dientes íntegros y que a medida que se incrementaba el ancho intercuspídeo de las preparaciones, consecutivamente aumentaba el riesgo de fractura por estrés flexural ante la aplicación de fuerzas compresivas [33]. Esto cobra particular relevancia en aquellas cavidades oclusales aparentemente conservadoras con amalgamas antiguas o restauraciones no adheridas que posibilitan la generación de cracks en rodetes marginales y su consecutiva propagación en dentina por aumento de fuerzas tensiles, a causa de la desconexión inter cuspídea.
Foster (2019), a diferencia de Larson (1981), comparó la resistencia a la fractura in vitro de dientes molares, realizando mejoras metodológicas al incorporar como variables la profundidad cavitaria y la presencia de preparaciones proximales con y sin restaurar adhesivamente [34]. La mayor fragilidad y el peor de los escenarios se presentó en cavidades profundas con acceso endodóntico. Sin embargo, respecto a este último punto, resulta interesante destacar que la deshidratación establecida tradicionalmente como una causa principal de mayor fragilidad del diente desvitalizado no sería tal [35, 36]. Dietschi (2007) y (2008) señala que ni la pérdida de humedad ni de tenacidad dentinaria por efecto de una trepanación conservadora explicarían este debilitamiento, sino que la razón de esta mayor fragilidad estaría asociada al compromiso estructural generado por la extensión de la preparación cavitaria, ya que una trepanación cuidadosa sin cajas proximales reduciría la rigidez cuspídea entre un 5% y un 20%, mientras que una cavidad MOD en premolares sin trepanar genera una disminución de la rigidez promedio de hasta un 63%, principalmente por la pérdida de la integridad de los rodetes marginales, con una disminución aproximada de resistencia a la fractura cercana al 54% [35, 36]. Lo anterior es reforzado por Reeh y cols., quienes concluyeron que si el acceso endodóntico se realiza después de una preparación MOD profunda, la disminución de la rigidez cuspídea no es significativa en comparación con una cavidad MOD de similares características pero sin acceso endodóntico [37]. Complementariamente, Seow y cols. (2015), establecieron en premolares que una cavidad MOD con un ancho de istmo de 1/3 de la distancia inter cuspídea compromete su rigidez en hasta un 53%, y si el ancho es la mitad de esta distancia, la pérdida de rigidez podría alcanzar el 67% o más [38]. Esto, muy posiblemente como ya hemos comentado, por la interrupción del anillo periférico del esmalte y la pérdida de su condición de estructura pre-tensada [5, 6].
Sobre la base de la literatura expuesta, es interesante destacar que la principal diferencia respecto al diente integro y su consecuente debilitamiento estructural se establecería a nivel de la mayor profundidad cavitaria. El ancho de la preparación, si bien es un elemento a considerar, parece no ser el factor más determinante en cavidades cuya profundidad sea igual o menor a 4 mm. Hood nos presenta una interesante explicación biomecánica del debilitamiento estructural como consecuencia del incremento de la profundidad de las preparaciones: Las cúspides de cavidades profundas tienden a quedar aisladas y desconectadas del resto de la estructura coronaria, comportándose como una verdadera viga voladiza o en cantiléver frente a la carga oclusal. El piso cavitario actuaría como el punto de apoyo o eje de rotación de la flexión cuspídea. Flexión que aumentaría con el incremento de la profundidad cavitaria al aumentar, en consecuencia, la longitud del voladizo (brazo de potencia) o cantiléver [39]. Esto no significa que el ancho de la preparación carezca de importancia en lo que a debilitamiento estructural se refiere. Granito y Svensson (1991) son muy claros en señalar que el desplazamiento cuspídeo está en directa relación con la extensión, ancho y profundidad de la preparación. Se debe entender el debilitamiento del diente estructuralmente comprometido como un fenómeno no atribuible a una única variable, sino a una combinación de elementos que deben ser integrados y comprendidos como la expresión clínica de una condición multifactorial [40]. Esto cobra particular relevancia si consideramos que la carga compresiva se concentra y expresa como tensión en las esquinas inferiores de una cavidad [39]. Por lo tanto, la profundidad junto con el espesor residual de la base cuspídea son en combinación elementos clave en la toma de decisión respecto al diseño cavitario y necesidad de realizar reducción y cobertura cuspídea. Algunos autores sugieren una profundad de 5mm como límite para una restauración directa sin necesidad de indicar cobertura oclusal. Otros, como Scotti (2015) y Deliperi (2008), consideran que paredes cuyo ancho sea mayor a 2mm tampoco deberían reducirse ni ser objeto de cobertura [41, 42]. Al parecer no existiría entre los diferentes autores un total acuerdo respecto a los números (ancho y profundidad) que deben ser considerados al momento de indicar reducción y cobertura oclusal. Sin embargo y en acuerdo con Manhart y cols. (1999), el principal criterio seguiría siendo la profundidad por sobre el ancho de la preparación [43]. No obstante, también cabe destacar que los trabajos descritos fueron realizados con técnicas adhesivas convencionales sin la utilización de refuerzo de sistemas de fibras continuas o resinas reforzadas con sistemas de fibra continua.
P. Magne el año 2009, junto con presentar y proponer un interesante diseño experimental con metodología de análisis digital de elemento finito, planteó importantes conclusiones y recomendaciones de proyección clínica al establecer que la mayor pérdida de rigidez dentaria se presenta en cavidades MOD, donde los valores de desplazamiento por flexión no sólo son significativa, sino que dramáticamente superiores respecto al diente integro y a dientes obturados adhesivamente (179.4 um; 2.7 um; 6.9 um respectivamente) [3]. Enfatizando, nuevamente, la importancia de los rodetes marginales y oblicuos como elementos fundamentales de conexión y solidez estructural. Así también, se explicaría la gran cantidad de fracturas dentarias de dientes que no son reconectados adhesivamente al no lograr mitigar el estrés tensil, los fenómenos de flexión cuspídea, generación y propagación de cracks en dentina [3].
Respecto al manejo de dientes fisurados, no sólo el diagnóstico representa un gran desafío para el clínico, sino también su tratamiento e incluso algo tan básico y obvio como su correcta visualización si no se trabaja con estándares mínimos de iluminación, magnificación, aislación y limpieza del campo operatorio. No sería responsable afirmar que el manejo de un crack es una cuestión definida ni mucho menos simple. Las alternativas descritas en la literatura van desde la restauración adhesiva directa, pasando por tratamientos más agresivos con el sustrato dentario, hasta llegar a la indicación de extracción por considerarla una condición irreversible y siempre de mal pronóstico [44, 45].
Si bien parece no existir un protocolo de restauración universalmente validado, en general se acepta que el objetivo de la terapia de un crack es su eliminación por desgaste (disección) o, en su defecto, la desconexión e interrupción de su propagación en dentina a través de un micro-fresado localizado en algún punto de su trayectoria y cuya profundización no comprometa la cámara pulpar ni los tejidos periodontales. Posteriormente se debe considerar su inmovilización con un correcto y riguroso protocolo adhesivo, integrando todos aquellos aspectos relacionados con la optimización del potencial adhesivo, control de estrés de contracción de polimerización y una correcta transmisión del estrés funcional [12]. Esto, para evitar o atenuar el micro movimiento gen rado con la carga oclusal y su consecutiva propagación, fractura o falla catastrófica [6, 30-32, 44, 46].
Sin embargo y en contraposición a lo previamente expuesto, estudios recientes de tomografía de coherencia óptica sugieren que esta conducta de eliminación o de desconexión con instrumental rotatorio y/o sónico tendría un efecto particularmente contraproducente al favorecer la propagación en dentina de la fisura que paradójicamente se procura eliminar [47]. Recomendándose la utilización de microabrasión o arenado húmedo con óxido de aluminio como el método de desgaste y limpieza menos invasivo y el más conservador con el sustrato dentario previo a la implementación del protocolo adhesivo de sellado, reconexión e inmovilización.
A lo largo de esta discusión, hemos enfatizado la necesidad de extremar la rigurosidad de nuestro protocolo adhesivo. Primero, porque no estamos frente a pequeñas restauraciones convencionales, sino ante situaciones límite que representan un desafío adhesivo-restaurador extremo. Segundo, porque existe un consenso general de que la unión resina-dentina creada por los sistemas adhesivos se deterioran o degradan con el tiempo [48-52].
Para sistemas de grabado total (como el empleado en el presente artículo), una técnica deficiente de grabado e imprimación, pueden de-terminar una gradiente decreciente de difusión del adhesivo dentro de la dentina excesivamente desmineralizada e infiltrada de manera parcial dentro de una capa híbrida que quedaría con fibrillas de colágeno desnudas [48, 53, 54]. Esta situación también se ha descrito a nivel nanométrico para adhesivos autograbantes de 6ª generación pese a la capacidad de estos sistemas para grabar e imprimar simultáneamente la dentina. Fenómeno que se ve exacerbado para sistemas universales simplificados por la persistencia de agua asociada con la resina hidrofílica, a la formación de puentes de hidrógeno y fenómenos de difusión de agua [18, 55].
Se ha establecido que la degradación proteolítica de una dentina mal grabada e infiltrada de manera incompleta estaría causada por metaloproteinasas de la misma matriz dentinaria, no siendo necesario la presencia de enzimas bacterianas [56].
Ambos fenómenos de degradación (hidrolítica y enzimática), probablemente explicarían la desaparición casi completa de porciones de capas híbridas informada en estudios in-vitro cuyas muestras fueron sometidas a envejecimiento durante 4 años en agua [50].
Lo anterior, representa sólo una parte de la evidencia y fundamentos que sustentan la recomendación de emplear clorhexidina a modo de pre-primer y sistemas adhesivos denominados como “Gold Standard”, ya que los datos disponibles indican que los sistemas de grabado total de tres pasos o de 4ª generación y los sistemas de auto-grabado de 6ª generación de dos pasos ofrecerían el mejor rendimiento clínico y el mayor potencial adhesivo microtensil (25 a 35 MPa para esmalte y 40 a 60 MPa en dentina) [12, 17, 19, 45].
Complementariamente, y no exento de controversia, el protocolo biomimético recomienda la utilización de sistemas de fibras continuas de polietileno tejidas (no trenzadas) con un tratamiento de superficie que les permite su unión a resinas compuestas. Son varios los trabajos que muestran su rendimiento experimental significativo en la protección de interfases adhesivas o sustratos de menor potencial adhesivo (ej. dentina cariada); controlar estrés de contracción de polimerización, superficializar/modificar el patrón de falla adhesiva y/o cohesiva, generar reconexión cuspídea y detener o desviar la propagación de cracks [20-29, 57]. Recientemente Agrawal y cols. (2022), informaron que la utilización de un sistema de fibras continuas (Ribbond) aumentó significativamente la resistencia a la fractura de dientes estructuralmente comprometidos 2,19 veces en comparación con las cavidades restauradas con composite convencional. Lo particularmente interesante fue que la resistencia media a la fractura de los dientes restaurados con Ribbond fue 1,54 veces mayor en comparación con las cavidades restauradas con resinas reforzadas con fibra de vidrio cortas discontinuas (EverX posterior / GC Corporation). Sin embargo, esto último no debería ser necesariamente interpretado como “que lo uno excluye a lo otro”, ya que la principal indicación de resinas reforzadas con fibras cortas está en la recuperación de tenacidad cuando se reemplazan grandes volúmenes dentinarios [20].
El propósito de usar conceptos y protocolos restaurativos biomiméticos no es polemizar con visiones odontológicas tradicionales, sino procurar la máxima preservación del sustrato biológico (dental y periodontal), evitando desgastes innecesarios por requerimientos de anclaje macromecánico; mantener la vitalidad pulpar, aumentar la longevidad de nuestra técnica adhesiva y detener o, en su defecto, atenuar el ciclo de restaurativo [45].
Conclusión
La aproximación biomimética es siempre desde una perspectiva conservadora mínimamente invasiva, sin sacrificio innecesario de sustrato dentario ni pulpar por requerimiento de anclaje macromecánico.
La técnica adhesiva de sellado, reconexión, refuerzo y reconstrucción requiere entrenamiento y rigurosidad, recomendándose la utilización de un mínimo de magnificación a partir de 4x.
La utilización de postes y/o metales se aleja del paradigma biomimético, porque sobre-rigidizan el diente, carecen de un correcto rendimiento adhesivo y su tipo de falla tiende a ser de carácter irreparable o catastrófico.
La detección imagenológica de un crack es compleja y no siempre posible.
El diagnóstico es principalmente clínico basado en la sintomatología descrita por el paciente: dolor localizado al morder (principalmente al abrir después de generar el apriete dentario de un alimento u otro objeto interpuesto) y sensibilidad inexplicable al frío.
Hay poco consenso sobre qué es apropiado para restaurar un diente fisurado. A pesar del hecho de que no hay evidencia que apoye categóricamente la intervención preventiva de un crack asintomático, uno de los principales objetivos terapéuticos es evitar su propagación y posterior fractura a través de su disección, desconexión e inmovilización.
El principal objetivo del enfoque biomimético enfatiza la supervivencia del diente por sobre la duración de la restauración.
Referencias Bibliográficas
1. Magne, P., A. Versluis, and W.H. Douglas, Rationalization of incisor shape: experimental-numerical analysis. J Prosthet Dent, 1999. 81(3): p. 345-55.
2. Thompson, V.P., The tooth: An analogue for biomimetic materials design and processing. Dent Mater, 2020. 36(1): p. 25-42.
3. Magne, P. and T. Oganesyan, CT scan-based finite element analysis of premolar cuspal deflection following operative procedures. Int J Periodontics Restorative Dent, 2009. 29(4): p. 361-9.
4. Bazos, P. and P. Magne, Bio-emulation: biomimetically emulating nature utilizing a histo-anatomic approach; structural analysis. Eur J Esthet Dent, 2011. 6(1): p. 8-19.
5. Milicich, G., The compression dome concept: the restorative implications. Gen Dent, 2017. 65(5): p. 55-60.
6. Milicich, G. and J.T. Rainey, Clinical presentations of stress distribution in teeth and the significance in operative dentistry. Pract Periodontics Aesthet Dent, 2000. 12(7): p. 695-700; quiz 702.
7. Carvalho, M.A., et al., Current options concerning the endodonticallytreated teeth restoration with the adhesive approach. Braz Oral Res, 2018. 32(suppl 1): p. e74.
8. de Carvalho, M.A., et al., Fatigue and failure analysis of restored endodontically treated maxillary incisors without a dowel or ferrule. The Journal of Prosthetic Dentistry, 2022.
9. Lazari, P.C., et al., Survival of extensively damaged endodontically treated incisors restored with different types of posts-and-core foundation restoration material. J Prosthet Dent, 2018. 119(5): p. 769-776.
10. Magne, P., et al., Influence of no-ferrule and no-post buildup design on the fatigue resistance of endodontically treated molars restored with resin nanoceramic CAD/CAM crowns. Oper Dent, 2014. 39(6): p. 595-602.
11. Seo, D.G., et al., Analysis of factors associated with cracked teeth. J Endod, 2012. 38(3): p. 288-92.
12. Alleman, D.S., The Protocols of Biomimetic Restorative Dentistry: 2002 to 2017. INSIDE DENTISTRY, 2017: p. 64-73.
13. Elderton, R.J., Preventive (evidence-based) approach to quality general
dental care. Med Princ Pract, 2003. 12 Suppl 1: p. 12-21.
14. Alleman, D.S., Decoupling with time a solution to the problem of hierarchy of bondability. INSIDE DENTISTRY, August 2021: p. 35-41.
15. Deliperi, S., Functional and aesthetic guidelines for stress-reduced direct
posterior composite restorations. Oper Dent, 2012. 37(4): p. 425-31.
16. Deliperi, S., An alternative method to reduce polymerization shrinkage in direct posterior composite restorations. JADA, October 2002. Vol. 133.
17. Van Meerbeek, B., et al., Microtensile bond strengths of an etch&rinse and self-etch adhesive to enamel and dentin as a function of surface treatment. Oper Dent, 2003. 28(5): p. 647-60.
18. Pucci, C.R., et al., Water-associated attributes in the contemporary dentin bonding milieu. J Dent, 2018. 74: p. 79-89.
19. Sattabanasuk, V., et al., Resin adhesion to caries-affected dentine after different removal methods. Aust Dent J, 2006. 51(2): p. 162-9.
20. Vallittu, P., Clinical Guide to Principles of Fiber-Reinforced Composites in Dentistry. May 25, 2017.
21. Agrawal, V.S., A. Shah, and S. Kapoor, Effect of fiber orientation and placement on fracture resistance of large class II mesio-occluso-distal cavities in maxillary premolars: An in vitro study. J Conserv Dent, 2022. 25(2): p. 122-127.
22. Belli, S., N. Dönmez, and G. Eskitaşcioğlu, The effect of c-factor and flowable resin or fiber use at the interface on microtensile bond strength to dentin. J Adhes Dent, 2006. 8(4): p. 247-53.
23. Belli, S., A. Erdemir, and C. Yildirim, Reinforcement effect of polyethylene fibre in root-filled teeth: comparison of two restoration techniques. Int Endod J, 2006. 39(2): p. 136-42.
24. Belli, S., et al., The effect of fiber placement or flowable resin lining on microleakage in Class II adhesive restorations. J Adhes Dent, 2007. 9(2): p. 175-81.
25. Bijelic, J., et al., Fracture load of tooth restored with fiber post and experimental short fiber composite. Open Dent J, 2011. 5: p. 58-65.
26. Deliperi, S., D. Alleman, and D. Rudo, Stress-reduced Direct Composites for the Restoration of Structurally Compromised Teeth: Fiber Design According to the "Wallpapering" Technique. Oper Dent, 2017. 42(3): p. 233-243.
27. Forster, A., et al., In vitro fracture resistance of endodontically treated premolar teeth restored with a direct layered fiber-reinforced composite post and core. Journal of Adhesion Science and Technology, 2016: p. 1-13.
28. Jakab, A., et al., Mechanical Performance of Direct Restorative Techniques Utilizing Long Fibers for "Horizontal Splinting" to Reinforce Deep MOD Cavities-An Updated Literature Review. Polymers (Basel), 2022. 14(7).
29. Sáry, T., et al., Fracture behaviour of MOD restorations reinforced by various fibre-reinforced techniques An in vitro study. J Mech Behav Biomed Mater, 2019. 98: p. 348-356.
30. Banerji, S., S.B. Mehta, and B.J. Millar, Cracked tooth syndrome. Part 1: aetiology and diagnosis. Br Dent J, 2010. 208(10): p. 459-63.
31. Cameron, C.E., Cracked-tooth syndrome. The Journal of the American
Dental Association, 1964. 68(3): p. 405-411.
32. Lynch, C.D. and R.J. McConnell, The cracked tooth syndrome. J Can Dent
Assoc, 2002. 68(8): p. 470-5.
33. Larson, T.D., W.H. Douglas, and R.E. Geistfeld, Effect of prepared cavities on the strength of teeth. Oper Dent, 1981. 6(1): p. 2-5.
34. Forster, A., et al., In Vitro Fracture Resistance of Adhesively Restored Molar Teeth with Different MOD Cavity Dimensions. J Prosthodont, 2019. 28(1): p. e325-e331.
35. Dietschi, D., et al., Biomechanical considerations for the restoration of endodontically treated teeth: a systematic review of the literature--Part 1. Composition and microand macrostructure alterations. Quintessence Int, 2007. 38(9): p. 733-43.
36. Dietschi, D., et al., Biomechanical considerations for the restoration of endodontically treated teeth: a systematic review of the literature, Part II (Evaluation of fatigue behavior, interfaces, and in vivo studies). Quintessence Int, 2008. 39(2): p. 117-29.
37. Reeh, E.S., H.H. Messer, and W.H. Douglas, Reduction in tooth stiffness as a result of endodontic and restorative procedures. J Endod, 1989. 15(11): p. 512-6.
38. Seow, L.L., C.G. Toh, and N.H. Wilson, Strain measurements and fracture resistance of endodontically treated premolars restored with all-ceramic restorations. J Dent, 2015. 43(1): p. 126-32.
39. Hood, J.A., Biomechanics of the intact, prepared and restored tooth: some clinical implications. Int Dent J, 1991. 41(1): p. 25-32.
40. Granath, L. and A. Svensson, Elastic outward bending of loaded buccal and lingual premolar walls in relation to cavity size and form. Scand J Dent Res, 1991. 99(1): p. 1-7.
41. Deliperi, S. and D.N. Bardwell, Multiple cuspal-coverage direct composite restorations: functional and esthetic guidelines. J Esthet Restor Dent, 2008. 20(5): p. 300-8; discussion 309-12.
42. Scotti, N., et al., Longevity of class 2 direct restorations in root-filled teeth: A retrospective clinical study. J Dent, 2015. 43(5): p. 499-505.
43. Manhart, J., et al., Mechanical properties and wear behavior of light-cured packable composite resins. Dent Mater, 2000. 16(1): p. 33-40.
44. Banerji, S., S.B. Mehta, and B.J. Millar, Cracked tooth syndrome. Part 2: restorative options for the management of cracked tooth syndrome. Br Dent J, 2010. 208(11): p. 503-14.
45. Alleman, D.S. and P. Magne, A systematic approach to deep caries removal end points: the peripheral seal concept in adhesive dentistry. Quintessence Int, 2012. 43(3): p. 197-208.
46. Lubisich, E.B., T.J. Hilton, and J. Ferracane, Cracked teeth: a review of the literature. J Esthet Restor Dent, 2010. 22(3): p. 158-67.
47. Hovander, D., et al., Optical coherence tomography evaluation of deep dentin crack removal techniques. JADA Foundational Science, 2022. 1.
48. Armstrong, S.R., J.C. Keller, and D.B. Boyer, The influence of water storage and C-factor on the dentin-resin composite microtensile bond strength and debond pathway utilizing a filled and unfilled adhesive resin. Dent Mater, 2001. 17(3): p. 268-76.
49. Burrow, M.F., M. Satoh, and J. Tagami, Dentin bond durability after three years using a dentin bonding agent with and without priming. Dent Mater, 1996. 12(5): p. 302-7.
50. De Munck, J., et al., Four-year water degradation of total-etch adhesives bonded to dentin. J Dent Res, 2003. 82(2): p. 136-40.
51. Gwinnett, A.J. and S. Yu, Effect of long-term water storage on dentin bonding. Am J Dent, 1995. 8(2): p. 109-11.
52. Pashley, D.H., et al., Collagen degradation by host-derived enzymes du-
ring aging. J Dent Res, 2004. 83(3): p. 216-21.
53. Hashimoto, M., et al., Micromorphological changes in resin-dentin bonds
after 1 year of water storage. J Biomed Mater Res, 2002. 63(3): p. 306-11.
54. Wang, Y. and P. Spencer, Quantifying adhesive penetration in adhesive/ dentin interface using confocal Raman microspectroscopy. J Biomed Mater Res, 2002. 59(1): p. 46-55.
55. Sano, H., et al., Comparative SEM and TEM observations of nanoleakage
within the hybrid layer. Oper Dent, 1995. 20(4): p. 160-7.
56. Martin-De Las Heras, S., A. Valenzuela, and C.M. Overall, The matrix metalloproteinase gelatinase A in human dentine. Arch Oral Biol, 2000. 45(9): p. 757-65.
57. Sadr, A., et al., Effects of fiber reinforcement on adaptation and bond strength of a bulk-fill composite in deep preparations. Dental Materials, 2020. 36.





