Revista Canal Abierto 44 | Artículo Científico
Capacidad de limpieza en paredes dentinarias de soluciones de irrigación endodónticas quelantes con y sin ultrasonido
Aceptado: 23-06-2021
Páginas 14-22
Molina María Emilia1 Oliva María Andrea1 López Gabriela Lucía2 De la Casa María Luisa2 Manlla Alberto Marcial3 López María Elena1
1 Cátedra de Química Biológica. Facultad de Odontología. Universidad Nacional de Tucumán. Argentina
2 Cátedra de Endodoncia. Facultad de Odontología. Universidad Nacional de Tucumán. Argentina
3 Cátedra de Matemáticas. Facultad de Agronomía y Zootecnia. Universidad Nacional de Tucumán. Argentina
Resumen
Objetivo: Evaluar el grado de limpieza del tercio apical de dentina radicular ex vivo por acción de diferentes soluciones quelantes, con y sin el uso de ultrasonido mediante microscopía electrónica de barrido.
Materiales y métodos: 40 premolares unirradiculares inferiores fueron instrumentados mecánicamente con el sistema Mtwo e irrigados con agua destilada. Las muestras fueron divididas en 2 grupos (n=20): Grupo 1, irrigación final manual convencional; Grupo 2, irrigación final ultrasónica. A su vez, cada grupo fue dividido según cada solución a analizar (n=5): a) Agua destilada (control); b) EDTA 17%; c) Ácido acético 5%; d) Ácido maleico 5%. Las muestras fueron cortadas longitudinalmente y examinadas bajo microscopía electrónica de barrido a 1000x en el tercio apical. Las imágenes obtenidas se cuantificaron con un score y los datos se analizaron estadísticamente mediante el test Z adoptando un nivel de significancia de 0,05.
Resultados: No se evidenciaron diferencias estadísticamente significativas en la proporción de túbulos dentinarios abiertos del tercio apical al emplear irrigación manual o ultrasónica. Todas las soluciones presentaron menor proporción de túbulos obliterados respecto al control. EDTA 17% sin ultrasonido y ácido maleico 5% con ultrasonido mostraron significativamente mayor proporción de túbulos sin barro dentinario respecto al resto de las soluciones.
Conclusiones: El grado de limpieza del tercio apical radicular producido por soluciones de irrigación quelantes resultó similar al emplear irrigación manual o ultrasónica. De las soluciones analizadas, EDTA 17% sin ultrasonido y ácido maleico 5% con ultrasonido evidenciaron mayor grado de limpieza.
Palabras clave: soluciones de irrigación, activación ultrasónica, microscopio electrónico de barrido.
Abstract
Objective: TTo evaluate the degree of cleaning of the apical third of root dentin by the action of different chelating solutions ex vivo, with and without the use of ultrasonic activation by scanning electron microscopy.
Materials and methods: 40 lower single-rooted premolars were mechanically instrumented with the Mtwo system and irrigated with distilled water. The samples were divided into 2 groups (n = 20): Group 1, conventional manual final irrigation; Group 2, final ultrasonic irrigation. Each group was divided according to the solution to be analyzed (n = 5): a) Distilled water (control); b) 17% EDTA; c) 5% Acetic acid; d) 5% Maleic acid. The samples were cut longitudinally and examined under scanning electron microscopy at 1000x in the apical third. The images obtained were quantified with a score and the data were statistically analyzed using the Z test, adopting a significance level of 0.05.
Results: There were no statistically significant differences in the proportion of open dentin tubules in the apical third when using manual or ultrasonic irrigation. All solutions had a lower proportion of obliterated tubules compared to the control. 17% EDTA without ultrasonic activation and 5% maleic acid with ultrasonic activation showed a significantly higher proportion of tubules without smear layer than the rest of the solutions.
Conclusions: The degree of cleaning of the root apical third produced by chelating irrigation solutions was similar when using manual or ultrasonic irrigation. Nevertheless, 17% EDTA without ultrasonic activation and 5% maleic acid with ultrasonic activation showed a higher degree of cleanliness.
Keywords: irrigation solutions, ultrasonic activation, scanning electron microscopy.
Introdución
La irrigación es una parte clave del tratamiento del canal radicular. Se considera que es el método más adecuado para remover los restos de tejido y el barro dentinario producidos durante la preparación (1). El barro dentinario, que es amorfo e irregular en su estructura, contiene componentes orgánicos como microorganismos y sus productos metabólicos, restos necróticos, tejido pulpar y procesos odontoblásticos así como componentes inorgánicos de la dentina (2).La remoción del barro dentinario aumenta la permeabilidad dentinaria (3), mejorando la difusión y la acción de la medicación intermedia (4) permitiendo y produciendo una mejor penetración del material de sellado dentro de los canales laterales y túbulos dentinarios (5).
Los métodos actuales para eliminar el barro dentinario implican el uso de un agente quelante en combinación con otros irrigantes que tienen propiedades de disolución tisular (6,7).
El ácido etilendiaminotetraacético (EDTA) es una solución quelante de cationes bivalentes que forma complejos estables con iones calcio de la dentina resultando una desmineralización de la superficie del canal radicular (8). Se desmostró que el EDTA descalcifica la dentina dentro de los 5 minutos a una profundidad aproximada de 20-30 μm (9).
La utilización de EDTA 17% seguido por una irrigación con hipoclorito de sodio durante la instrumentación del canal radicular se ha sugerido como efectiva para la remoción del barro dentinario de las paredes dentinarias (10).
Se evidenció que el uso de EDTA 17% causa erosión de la dentina radicular (11). Se propusieron otras sustancias para eliminar el barro dentinario, como el vinagre de manzana (12, 13), el ácido maleico (AM) (14, 15) y el ácido cítrico (AC) (16). El vinagre de manzana está compuesto por ácido acético (AA) 5% y ácido málico al 0,35% (17), tiene buena relación costo-eficacia y es una sustancia biocompatible (12). Su potencial antimicrobiano ha sido demostrado (18) pero poco se ha publicado acerca de su capacidad de limpieza (19).
El AM es un ácido orgánico suave que remueve el barro dentinario de la superficie de los dientes (15) y sería menos citotóxico que el EDTA (20).
La región apical es la porción del canal que presenta mayor dificultad para la limpieza, esto puede atribuirse a las estrechas dimensiones que presenta, lo que impide una efectiva distribución de los irrigantes y limita el contacto de las soluciones con las paredes del canal (21).
La eficacia de la irrigación depende tanto del irrigante (22) como de su modo de administración (23). Se comprobó que la irrigación con aguja en un sistema cerrado es ineficaz para administrar el volumen y la presión adecuados del irrigante en el tercio apical (24). Se propone el uso de ultrasonido durante y al final de la preparación del canal radicular para favorecer el efecto de limpieza de las soluciones de irrigación (25, 26, 27, 28, 29). La efectividad del ultrasonido en la irrigación es determinada por la habilidad de producir cavitación y una transmisión acústica. Crea burbujas de presión positiva y negativa en las moléculas del líquido con las que entran en contacto. Plotino y cols. 2007, demostraron que una activación ultrasónica de 30 segundos a 1 minuto es un tiempo suficiente para la limpieza del canal al final de la preparación. (30)
El objetivo de este trabajo fue evaluar el grado de limpieza del tercio apical de dentina radicular ex vivo por acción de diferentes soluciones quelantes con y sin el uso de ultrasonido mediante microscopía electrónica de barrido (MEB).
Materiales y Métodos
Se emplearon cuarenta premolares inferiores unirradiculares humanos, recientemente extraídos por motivos ortodóncicos, previo consentimiento informado, de pacientes de ambos sexos de 20 a 30 años de edad. Los mismos fueron seleccionados en base a su similitud en morfología y tamaño, descartando aquellos que presentaban más de un canal. Fueron almacenados en solución fisiológica a 4°C hasta su utilización. No se emplearon soluciones desinfectantes a fin de evitar modificaciones en las variables analizadas. Se cortaron las coronas a nivel de la unión amelo-cementaria, utilizando piedra diamantada no 2200 (KG Sorensen, San Pablo, Brasil) con pieza de mano de alta rotación y abundante refrigeración.
Las raíces fueron instrumentadas mecánicamente con la secuencia básica del sistema Mtwo (VDW, Munich, Alemania) hasta la lima 25/06, y motor VDW (Silver, Munich, Alemania), siguiendo las indicaciones del fabricante. Para la determinación de la longitud de trabajo, se exploró el canal con una lima K-file #10 en toda su extensión, hasta observar que la punta de esta fuera visible en el foramen apical de la raíz. A esta medida así registrada se le restó 1 mm, determinando la longitud de trabajo. Durante la preparación se irrigó con 2 ml de agua destilada (AD) entre la utilización de cada lima.
Posteriormente, las muestras se dividieron al azar en 2 grupos: 1) irrigación final manual convencional, sin ultrasonido (SU); 2) irrigación final ultrasónica, con ultrasonido (CU). A su vez, cada grupo fue dividido según cada solución a analizar (n=5): a) AD (control); b) EDTA 17%; c) AA 5%; d) AM 5%. Las soluciones de irrigación fueron preparadas en el Laboratorio de la Cátedra de Química Biológica de la Facultad de Odontología de la Universidad Nacional de Tucumán, hasta 24 horas antes de realizar el experimento. Se ajustó el pH de la solución de EDTA 17% con hidróxido de sodio para llevarla a la neutralidad (pH 7,2). Se mantuvieron a 4°C hasta su utilización.
La irrigación final del Grupo 1 (SU) se realizó en cada raíz utilizando aguja 25G (Becton Dickinson Precision Glide, Curitiba, Brasil) y jeringa de 5 ml (Becton Dickinson, Buenos Aires, Argentina), aplicando la cantidad necesaria de solución para llenar por completo el canal. Luego de 5 minutos de contacto, se lavó con 5 ml de AD. Para cada espécimen se preparó un taco de cera rosa, que permitió mantener la muestra vertical, asegurando que la solución se mantenga en el interior del canal y en contacto con las paredes el tiempo deseado sin derramarse.
En el caso de las raíces del Grupo 2 (CU), la irrigación se realizó de la misma manera que en el Grupo 1 durante 5 minutos. Pero en este caso, en el primer minuto las soluciones fueron activadas con ultrasonido (Ultrasonic Scaler UDS-E LED, Woodpecker, Guilin, Guangxi, China), empleando una punta inactiva que quedaba holgada en el interior del canal, sin contactar con las paredes de este, a una potencia 2, equivalente al 50% del máximo.
Una vez completada la conformación y la irrigación de las raíces, en ambos grupos, los canales se secaron con puntas de papel estéril.
Posteriormente, las raíces se cortaron longitudinalmente en sentido vestíbulo-lingual, realizando muescas con una piedra troncocónica n° 2200 (KG Sorensen, San Pablo, Brasil) tanto por vestibular y lingual, sin penetrar en el canal, y fueron finalmente separadas en dos mitades con la ayuda de una espátula para cemento y un martillo, resultando 2 mitades por diente (total=80 mitades). Las muestras fueron almacenadas en tubos eppendorf a 4° C hasta su utilización.
Luego de los procedimientos descritos, cada muestra fue secada con papel de filtro y procesada según el protocolo para MEB (1°- Fijación con glutaraldheído en buffer fosfato; 2°- Deshidratación en alcohol etílico de graduación creciente y acetona 100%; 3°- Desecación a temperatura ambiente, congelación hasta llegar al punto crítico de secado; 4°- Montaje en stubs; 5°- Metalización).
Se realizó una primera observación en MEB (Jeol JSM 35 CF, Mundelein, Illinois 60060 USA) a 20x para determinar el área de observación, la cual se fijó a 2 mm del límite apical y a 1 mm del límite cemento-dentinario. Las imágenes se tomaron a una magnificación de 1000x y 2000x. Cada imagen se transfirió al editor de imágenes Paint Windows y sobre la misma se superpuso una trama cuadriculada, donde cada lado de un cuadrado representaba 20 μm. Así, se otorgó un porcentaje a cada imagen, que reflejaba el grado de limpieza de la pared dentinaria midiendo la cantidad de túbulos abiertos por cuadrado. Finalmente, cada muestra fue puntuada con un score (31): 0= 100% de los túbulos abiertos; 1= más del 50% de los túbulos abiertos; 2= menos del 50% de los túbulos abiertos; 3= 0% de los túbulos abiertos.
Para comparar las proporciones de cada solución dentro de un determinado score se utilizó el Test Z. El nivel de significancia adoptado fue 0,05.
Resultados
Al comparar la irrigación manual con la ultrasónica en el tercio apical de los canales radiculares, no se evidenciaron diferencias estadísticamente significativas en la proporción de túbulos dentinarios abiertos. Sin embargo, todas las soluciones presentaron menor proporción de túbulos obliterados respecto al control.
Los resultados expresados en las tablas y figuras, se manifiestan en las imágenes obtenidas con MEB para las distintas soluciones.
En la Figura 1 se observan los distintos scores para todas las soluciones empleadas SU. Si bien se evidencia que EDTA 17% fue la única solución que presentó niveles de score 0 y score 1, no hubo diferencias significativas con el resto de las soluciones (Tabla 1), mientras que EDTA 17% fue la solución que significativamente presentó menor proporción de túbulos obliterados (score 3).
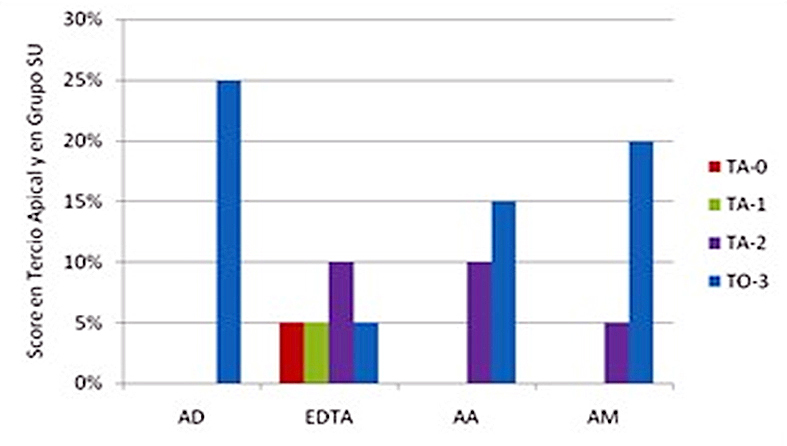
Figura 1. Scores en tercio apical luego del contacto con soluciones sin ultrasonido. milímetros.
AD: Agua destilada; EDTA: EDTA 17%; AA: Acido acético 5%; AM: Acido Maleico 5%. TA-0: Totalidad de túbulos abiertos; TA-1: más de 50%de túbulos abiertos; TA-2: menos de 50% de túbulos abiertos; TO-3: totalidad de túbulos obliterados.
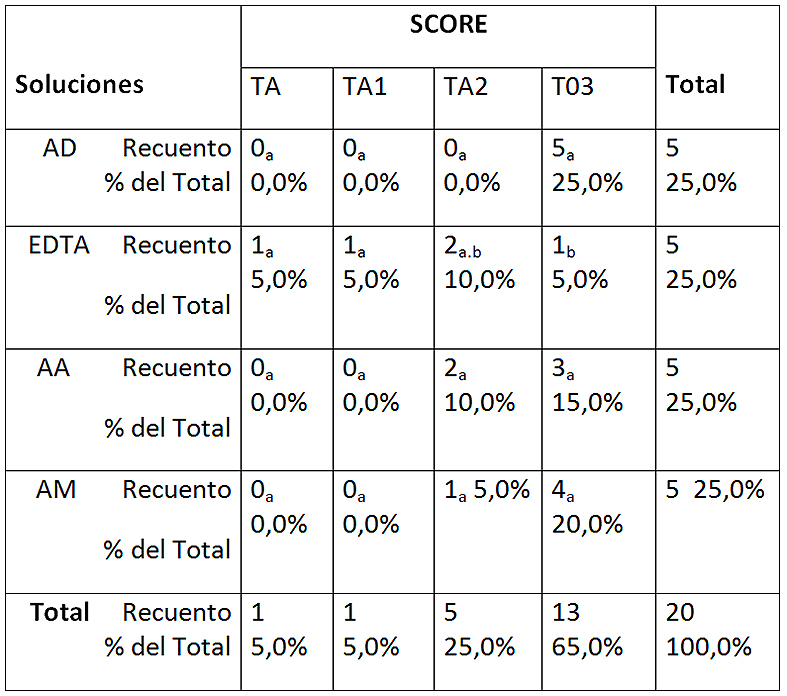
Tabla 1: Tabla de contingencia entre soluciones y score sin ultrasonido
Cada letra de subíndice indica un subconjunto de SCORE categorías cuyas proporciones de columna no difieren significativamente entre sí en el nivel 0.05. AD: agua destilada; EDTA: EDTA 17%; AA: ác. Acético 5%; AM: ác. Maleico 5%. TA-0: totalidad túbulos abiertos; TA-1: más de 50% túbulos abiertos; TA-2: menos de 50% túbulos abiertos; TO-3: totalidad túbulos obliterados.
En la Figura 2 se observan los diferentes scores en todas las soluciones utilizadas CU. Ninguna de las soluciones evidenció 100% de túbulos abiertos. AM no mostró túbulos obliterados (score 3), observándose diferencias significativas con respecto al resto de las soluciones. Además esta misma solución cuantificó la mayor proporción de score 1, aunque no fue significativamente diferente al de las otras soluciones (Tabla 2).
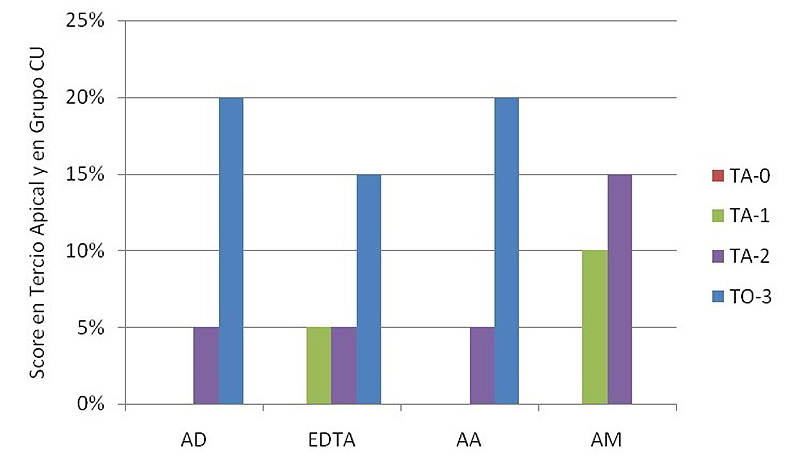
Figura 2. Scores en tercio apical luego del contacto con soluciones con ultrasonido.
AD: Agua destilada; EDTA: EDTA 17%; AA: Acido acético 5%; AM: Acido Maleico 5%. TA-0: Totalidad de túbulos abiertos; TA-1: más de 50%de túbulos abiertos; TA-2: menos de 50% de túbulos abiertos; TO-3: totalidad de túbulos obliterados.
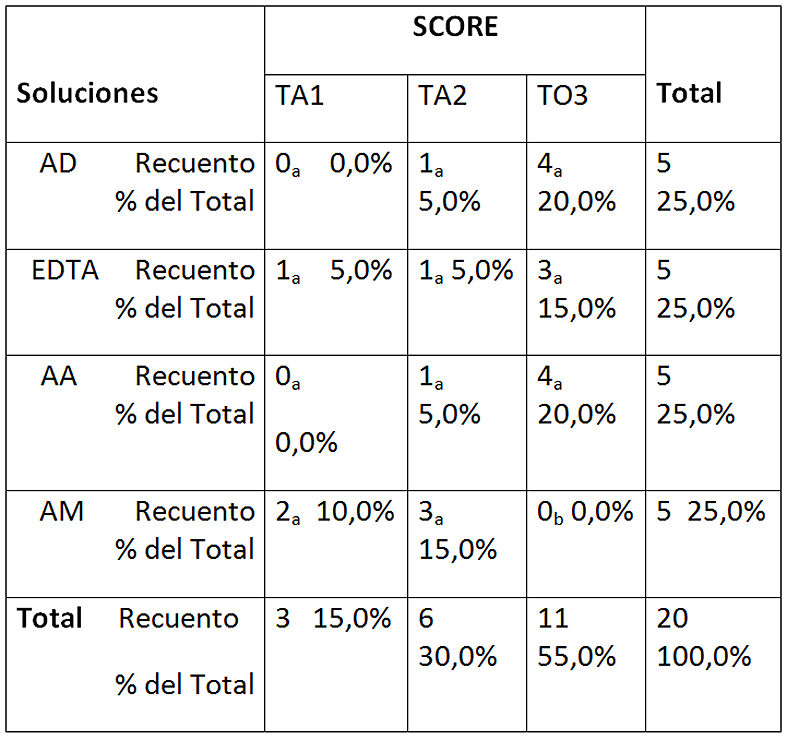
Tabla 2: Tabla de contingencia entre soluciones y score con ultrasonido
Cada letra de subíndice indica un subconjunto de SCORE categorías cuyas proporciones de columna no difieren significativamente entre sí en el nivel .05. AD: agua destilada; EDTA: EDTA 17%; AA: ác. Acético 5%; AM: ác. Maleico 5%. TA-1: más de 50% túbulos abiertos; TA-2: menos de 50% túbulos abiertos; TO-3: totalidad túbulos obliterados.
En la Figura 3 se comparan los distintos scores de EDTA 17% CU y SU. A pesar de que no existen diferencias estadísticamente significativas entre los grupos analizados, sólo se observan 100% de túbulos abiertos en el grupo SU y 100% de túbulos obliterados en el grupo CU (Tabla 3).
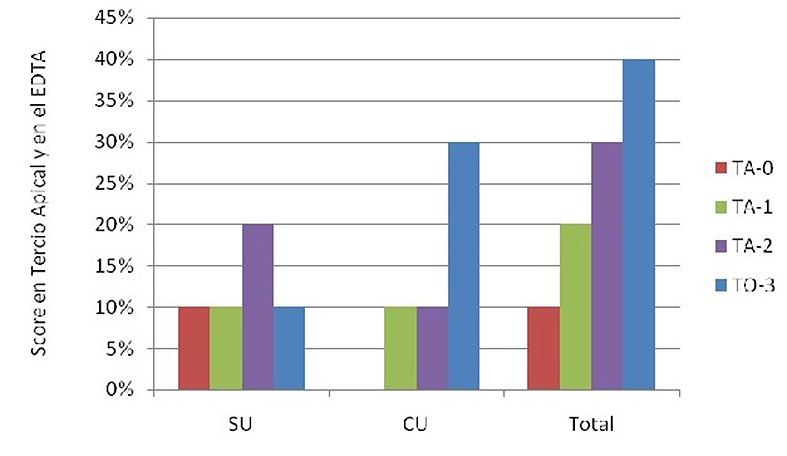
Figura 3. Scores en tercio apical luego del contacto con EDTA 17% sin ultrasonido y con ultrasonido.
CU: con ultrasonido; SU: sin ultrasonido. TA-0: Totalidad de túbulos abiertos; TA-1: más de 50%de túbulos abiertos; TA-2: menos de 50% de túbulos abiertos; TO-3: totalidad de túbulos obliterados.
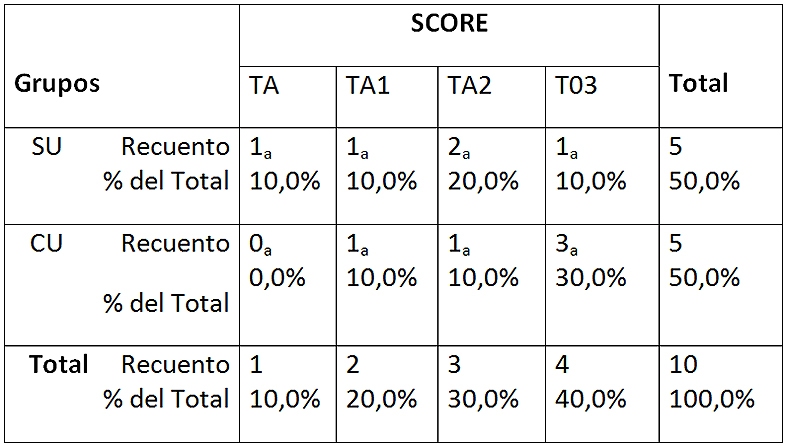
Tabla 3: Tabla de contingencia entre los scores y los grupos en EDTA 17%
Cada letra de subíndice indica un subconjunto de SCORE categorías cuyas proporciones de columna no difieren significativamente entre sí en el nivel .05. SU: sin ultrasonido; CU: con ultrasonido TA-0: totalidad túbulos abiertos; TA-1: más de 50% túbulos abiertos; TA-2: menos de 50% túbulos abiertos; TO-3: totalidad túbulos obliterados.
En la Figura 4 se analizan los porcentajes de scores para el AA cotejando el uso o no de ultrasonido. Ningún grupo presentó scores 0 y 1. A pesar de haberse evidenciado mayor porcentaje de túbulos 100% obliterados en el grupo CU y de score 2 en el grupo SU, no se evidenciaron diferencias estadísticas entre los grupos (Tabla 4).
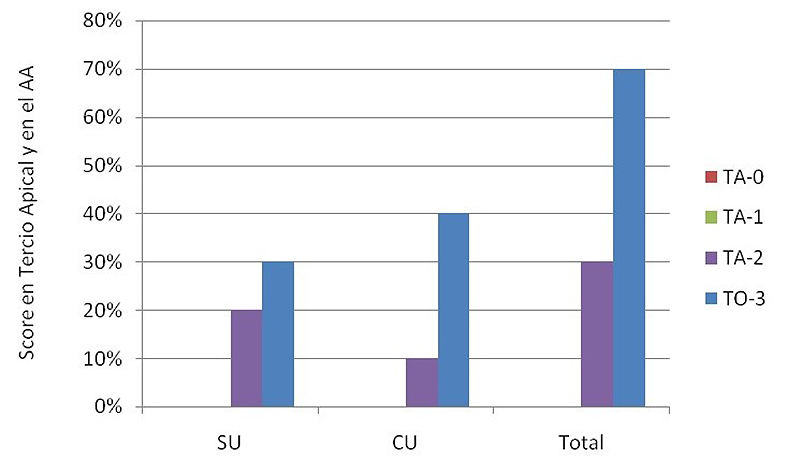
Figura 4. Scores en tercio apical luego del contacto con ácido acético 5% sin ultrasonido y con ultrasonido.
CU: con ultrasonido; SU: sin ultrasonido. TA-0: Totalidad de túbulos abiertos; TA-1: más de 50%de túbulos abiertos; TA-2: menos de 50% de túbulos abiertos; TO-3: totalidad de túbulos obliterados.
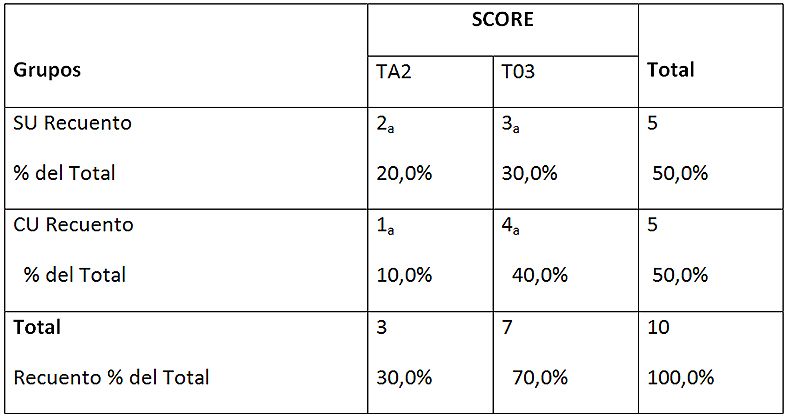
Tabla 4: Tabla de contingencia entre los scores y los grupos en EDTA 17%
Cada letra de subíndice indica un subconjunto de SCORE categorías cuyas proporciones de columna no difieren significativamente entre sí en el nivel .05. SU: sin ultrasonido; CU: con ultrasonido TA-0: totalidad túbulos abiertos; TA-1: más de 50% túbulos abiertos; TA-2: menos de 50% túbulos abiertos; TO-3: totalidad túbulos obliterados.
En la Figura 5 se analizan los scores para AM CU y SU (Figura D 1 y D2). No se observan en ninguno de los dos grupos el score 0. Si bien se manifiesta que el grupo SU presenta mayor proporción de túbulos 100% obliterados y el grupo CU presenta mayor proporción de score 1, no hubo diferencias significativas entre los grupos analizados. Score 1 se hace visible para el grupo CU sin ser estadíticamente significativo (Tabla 9).
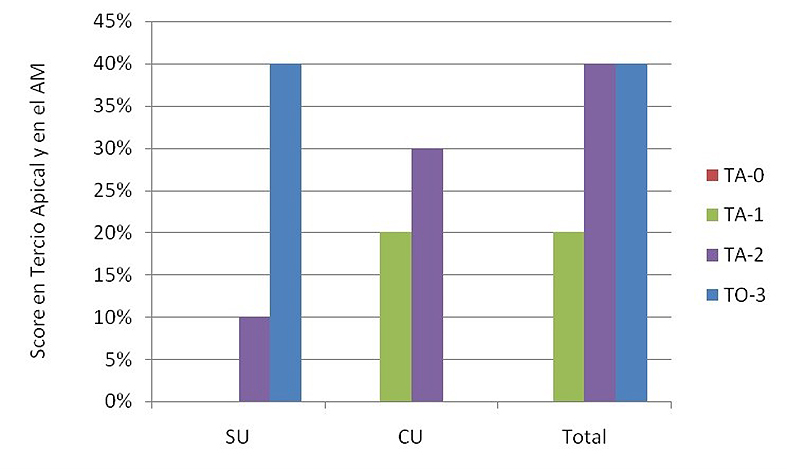
Figura 5. Scores en tercio apical luego del contacto con ácido maleico sin ultrasonido y con ultrasonido.
CU: con ultrasonido; SU: sin ultrasonido. TA-0: Totalidad de túbulos abiertos; TA-1: más de 50%de túbulos abiertos; TA-2: menos de 50% de túbulos abiertos; TO-3: totalidad de túbulos obliterados.
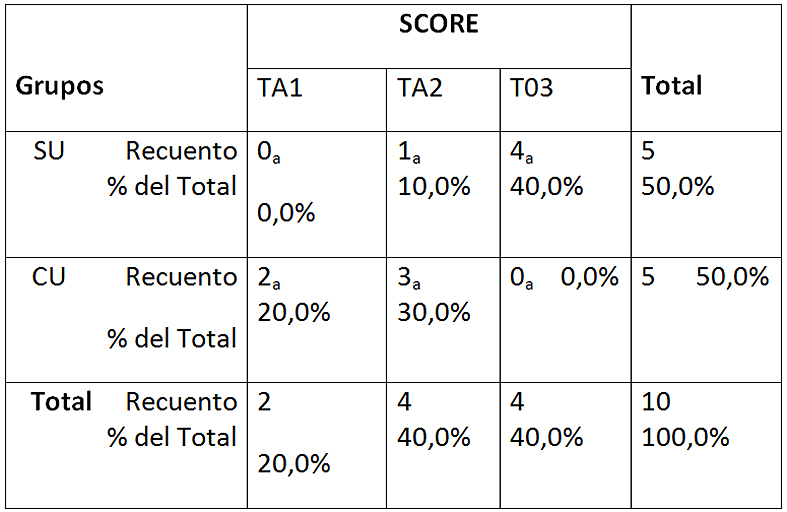
Tabla 5: Tabla de contingencia entre los scores y los grupos en ácido maleico 5%
Cada letra de subíndice indica un subconjunto de SCORE categorías cuyas proporciones de columna no difieren significativamente entre sí en el nivel .05.SU: sin ultrasonido; CU: con ultrasonido. TA-1: más de 50% túbulos abiertos; TA-2: menos de 50% túbulos abiertos; TO-3: totalidad túbulos obliterados.

Figura 6. Fotografías con microscopía electrónica de barrido del tercio apical de dentina radicular humana (1000 x). A: Agua destilada. B: EDTA 17%. C: Ácido acético 5%. D: Ácido maleico 5%. 1: sin ultrasonido. 2: con ultrasonido.
Discusión
En este estudio se evaluó el comportamiento de agentes quelantes como EDTA 17%, AM 5% y AA 5%, en la remoción del barro dentinario del tercio apical de dentina radicular ex vivo comparando sus efectos con y sin ultrasonido mediante microscopía electrónica de barrido.
Diversos estudios recomiendan el uso de ultrasonido durante la irrigación del canal radicular para aumentar el efecto de limpieza de las soluciones irrigantes (32,33) y el efecto antibacterial (29). Sin embargo, los resultados de este trabajo, al igual que los estudios de Gu y cols. (2009), Fuat y cols. (2014) y Rodrigues y cols. (2013), no demostraron diferencias al usar esta técnica o irrigación manual. (19,33,34)
Pranav y cols. (2015), por su parte, demostraron que la activación con ultrasonido favorece la acción de los irrigantes endodónticos (35), pero se debe tener en cuenta que, en su estudio, utilizaron un régimen de irrigación combinado, que incluye el uso de soluciones solventes de tejido orgánico como NaClO en alternancia con una solución quelante.
Según Plotino y cols. (2016), la agitación ultrasónica de NaClO mejoraría la limpieza del canal radicular (26). Sin embargo, en este estudio se usaron exclusivamente agentes quelantes.
El tiempo en que se emplea la activación ultrasónica influiría en los efectos de la misma. Si bien Cameron (1983), manifestó mejores resultados al usarse durante 3 minutos(36), Kuah y cols. (2009) determinaron que una activación ultrasónica de 1 minuto sería suficiente para producir la remoción de detritus del tercio apical al usar EDTA 17%(37). Debido a que se demostró que la irrigación ultrasónica podría producir erosión de la dentina subyacente, afectando las propiedades mecánicas de la misma (38), se optó por usar un bajo tiempo de activación ultrasónica.
Por otro lado, a pesar de que clínicamente suele emplearse soluciones de hipoclorito de sodio durante todo el tratamiento endodóntico, en este estudio se utilizó durante la instrumentación agua destilada y sólo hipoclorito de sodio 1% como irrigación final a fin de controlar los tiempos de acción de esas soluciones.
Se seleccionó para el análisis el tercio apical del canal radicular por ser la porción más difícil de limpiar, ya que presenta estrechas dimensiones y una anatomía muy variada (deltas apicales, bifurcaciones de canales). Esto impide la efectiva penetración del irrigante, limitando el contacto de la solución con las paredes dentinarias (37). Ésta sería la razón de los resultados obtenidos en nuestro estudio, en donde se evidenció que, si bien todas las soluciones limpiaron el canal radicular, la proporción de túbulos totalmente abiertos fue casi nula para la mayoría de las soluciones estudiadas.
En el presente trabajo se demostró que EDTA 17% fue la solución que mejor limpió el tercio apical cuando no se utilizó ultrasonido. Este resultado es avalado por autores que sugieren que la acción del EDTA activado con US es menos efectiva (39). Por otro lado, al comparar el comportamiento de EDTA 17% con AM 5% los resultados no coinciden con los obtenidos por ciertos autores que demostraron que este último mejora significativamente el grado de limpieza del tercio apical (40, 41), mientras que otros trabajos si muestran coincidencia con este ensayo (42).
Al igual que en nuestros resultados, al compararlo con EDTA 17% y AM 5% durante 5 minutos de contacto, Kirchhoff y cols. (2013) evidenciaron que AA 5% fue la solución que menor capacidad de limpieza demostró, sin embargo su efecto fue superior respecto al control.(43)
Si bien todos los quelantes utilizados demostraron poder de limpieza, los mismos carecen de capacidad de remover materia orgánica, tejido necrótico o poder bactericida, propiedades necesarias para asegurar el éxito clínico del tratamiento endodóntico (43). Será necesario realizar nuevos estudios combinando quelantes con soluciones que presenten estas características.
Conclusión
A pesar de las dificultades anatómicas que presenta el tercio apical radicular, todas las soluciones analizadas limpiaron la dentina respecto al control. Sin embargo, la utilización de ultrasonido no llegó a evidenciar una mejoría en este sentido respecto a la irrigación manual, al menos en las soluciones y tiempos analizados en el presente trabajo.
Referencias Bibliográficas
1. Yang SE, Cha JH, Kim ES, Kum KY, Lee CY, Jung IY (2006) Effect of smear layer and chlorhexidine treatment on the adhesion of Enterococcus faecalis to bovine dentin. Journal of Endodontics, 32:663-7. 2. Tonini R., Giovarruscio M., Gorni F., Ionescu A., Brambilla E., Mikhailovna I.M., Luzi A., Maciel Pires P., Sauro S (2020). In Vitro Evaluation of Antibacterial Properties and Smear Layer Removal/ Sealer Penetration of a Novel Silver-Citrate Root Canal Irrigant. Materials (Basel) ;13(1):194.
3. Pashley DH, V Michelich V, Kehl T (1981). Dentin permeability: effects of smear layer removal. Journal of Prosthetic dentistry 46:531-7.
4. Orstavik D, Haapasalo M (1990). Disinfection by endodontic irrigants and dressing of experimentally infected dentinal tubules. Endododontics and Dental Traumatology, 6:142-49
5. Lloyd A, Thompson J, Gutmann JL, Dummer PMH (1995). Sealability of the Trifeca technique in the presence or absence of a smear layer. International Endodontic Journal 28, 35-40.
6. Zehnder M (2006). Root canals irrigants. Journal of Endodontics, 32:389-98
7. Berástegui E, Molinos E, Ortega J (2017). Comparison of standard and new chelating solutions in endodontics. Journal of Dental Sciences, 2(3):000131.
8. Darrag AM (2014). Effectiveness of different final irrigation solutions on smear layer removal in intraradicular dentin. Tanta Dental Journal, 11:93–9.
9. Kandaswamy D, Venkateshbabu N (2010). Root canal irrigants. Journal Conservative Dentistry 13 (4): 256-64.
10. Trevisan L., Huerta I.R., Michelon C., Bello M.D.C., Pillar R., Souza Bier C.A (2017). The Efficacy of Passive Ultrasonic Activation of Organic Solvents on Dissolving Two Root Canal Sealers. Iranian Endodontic Journal, 12:25–28.
11. Baldasso F, Roleto L, Silva V, Morgental R, Kopper P (2017). Effect of final irrigation protocols on microhardness reduction and erosion of root canal dentin. Brazilian Oral Reserch, 31:40.
12. Candeiro GTM, Matos IB, Costa CFE, Fonteles CSR, Vale MS (2011). A comparative scanning electron microscopy evaluation of smear layer removal with apple vinegar and sodium hypochlorite associated with EDTA. Journal of Applied Oral Science, 19(6):639-43. 13. Akbulut MB, Gunese MB, Eldeniz AU (2019). Effects of fruit vinegars on root dentin microhardness and roughness. Journal of Conservative Dentistry, 22 (1):97-101.
14. Butala R, Kabbinale P, Ballal V (2017). Comparative evaluation of ethylenediaminetetraacetic acid, maleic acid, and peracetic acid in smear layer removal from instrumented root canal system: A scanning electron microscopic analysis study. Saudi Endodontic Journal, 7(3):170-5.
15. Ballal NV, Mala K, Bhat KS (2011). Evaluation of decalcifying effect of maleic acid and EDTA on root canal dentin using energy dispersive spectrometer. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics,112:e78-e84.
16. De Deus G, Paciornik S, Mauricio MHP (2006). Evaluation of the effect of EDTA, EDTAC and citric acid on the microhardness of root dentine. International Endodontic Journal 39:401-6.
17. Caligliani A, Acquotti D, Palla G, Bocchi V (2007). Identification and quantification of the main organic components of vinegars by high resolution 1H NMR spectroscopy. Analytica Chimica Acta, 585(1):119-9.
18. Estrela C, Holland R, Bernabé PFE, Souza V, Estrela CRA (2004). Antimicrobial potential of medicaments used in healing process on dogs teeth with apical periodontitis. Brazilian Dental Journal, 15(3):181-5.
19. Rodrigues CT, Bernardineli N, Duarte MAH, Bramante CM, Andrade FB (2013). Evaluation of EDTA, apple vinegar and smear clear with and without ultrasonic activation on smear layer removal in different root canal levels. Dental Press Endodontics, 3(1):43-8.
20. Giardino L, Bidossi A, Del Fabbro M, Savadori P, Maddalone M, Ferrari L, Ballal NV, Das S, Rao BS (2020). Antimicrobial activity, toxicity and accumulated hard-tissue debris (AHTD) removal efficacy of several chelating agents. International Endodontic Journal, 53(8):1093-1110.
21. Park E, Shen Y, Khakpour M, Haapasalo M (2013). Apical pressure and extent of irrigant flow beyond the needle tip during positive-pressure irrigation in an in vitro root canal model. Journal of Endododontics.39 :511–5.
22. Haapasalo M, Shen Y, Wang Z, Gao Y (2014). Irrigation in endodontics. Brazilian Dental Journal, 216(6):299–303.
23. Hargreaves K, Berman L (2016). Cohen's Pathways of the Pulp. 11th ed. St.Louis, Missouri: Elsevier.
24. Abarajithan M, Dham S, Velmurugan N, Albuquerque VD, Ballal S, Senthilkumar H (2011). Comparison of EndoVac irrigation system with conventional irrigation for removal of intracanal smear layer: an in vitro study. Oral Surgery Oral Medicine Oral Pathology Oral Radiology, 112:407–411.
25. Leoni G, Versiani M, Silva-Sousa Y, Bruniera J, Pécora J, Sousa-Neto M (2017). Ex vivo evaluation of four final irrigation protocols on the removal of hard-tissue debris from the mesial root canal system of mandibular first molars. International Endodontic Journal, 50(4):398-406.
26. Plotino G, Cortese T, Grande NM, Leonardi DP, Di Giorgio G, Testarelli L, Gambarini G (2016). New technologies to improve root canal disinfection. Brazilian Dental Journal, 27(1):3-8.
27. Susila A, Minu J (2019). Activated Irrigation vs. Conventional non-activated Irrigation in Endodontics – A Systematic Review. European Endodontic Journal, 4(3):96-110.
28. Kharouf N, Pedulla E, La Rosa G, Kukiet F, Sauro S, Haikel Y, Mancino D (2020). In Vitro Evaluation of Different Irrigation Protocols on Intracanal Smear Layer Removal in Teeth with or without Pre-Endodontic Proximal Wall Restoration. Journal of Clinical Medicine, 9:2-14.
29. Qiang L, Zhang Q, Zou X, Yue L (2020). Evaluation of four final irrigation protocols for cleaning root canal walls. International Journal of Oral Science, 12:29.
30. Plotino G, Grande NM, Pameijer CH, Somma F (2007). Ultrasonics in Endodontics: a review of the literature. Journal of Endodontics, 33:81-95.
31. Kaya S, Adiguzel O, Uysal I, Ganidagli Ayaz S (2011). Effectiveness of three different application times of 17% EDTA and 7% maleic acid irrigation agents on the removal of debris and smear layer: a scanning electron microscope study. International Dental Research, 2:48-54.
32. Lui JN, Kuah HG y Chen NN. (2007). Effect of EDTA with and without Surfactants or Ultrasonics on Removal of Sear Layer. Journal of Endodontic, 33: 472-475.
33. Gu XH, Mao CY y Kern M. (2009). Effect of Different Irrigation on Smear Layer Removal after Post Space Preparation. Journal of Endodontic, 35:538-586.
34. Fuat A, Ali K, Neslihan S (2014). Effectiveness of different irrigation systems on smear layer removal: A scanning electron microscopic study. European Journal Dentistry, 8:53-57.
35. Pranav K, Aesha A, Manish B, Roshan U, Nirmal R, Tejal K, Hiral K (2015). Effectiveness of different irrigation techniques on smear layer removal in apical thirds of mesial root canals of permanent mandibular first molar: A scanning electron microscopic study. Journal of Conservative Dentistry 18:321-326.
36. Cameron JA (1983). The use of ultrasonics in the removal of the smear layer: a scanning electron microscope study. Journal of Endodontics, 9(7):289-92.
37. Kuah HG, Lui JN, Tseng P, Chen NN (2009). The effect of EDTA with and without ultrasonics on removal of the smear layer. Journal of Endodontics. 35(3):393-396.
38. Simezo AP, da Silveira Bueno CE, Sanches Cunha R, Pelegrine RA, Rocha D, Sigrist de Martin A, Shoji Kato A (2017). Comparative Analysis of Dentinal Erosion after Passive Ultrasonic Irrigation versus Irrigation with Reciprocating Activation: An Environmental Scanning Electron Study. Journal of Endodontics, 43:141-146.
39. Abbott PV, Heijkoop PS, Cardaci SC, Hume WR, Heithersay GS (1991). An SEM study of the effects of different irrigation sequences and ultrasonics. International Endodontic Journal, 24: 308–316.
40. Ballal NV, Kandian S, Mala K, Bhat SK, Acharya S (2009). Comparison of the efficacy of maleic acid and ethylenediaminetetraacetic acid in smear layer removal from instrumented human root canal: a scanning electron microscopic study. Journal of Endodontics, 35:1573-6.
41. Ravneet K, Ramta B, Sunil M (2020). A comparative evaluation of smear layer removal by using ethylenediamine tetraacetic acid, citric acid, and maleic acid as root canal irrigants: An in vitro scanning electron microscopic study. Journal of Conservative Dentristy, 23(1):71-78.
42. Hasheminia SM, Birang R, Nasouri M (2012). A Comparative Study of the Removal of Smear Layer by Two Endodontic Irrigants and Nd:YAG Laser: A Scanning Electron Microscopic Study. International Scholarly Research Notices, 10.5402/2012/620951.
43. Kirchhoff AL, Saravia Miranda CE, de Sousa Neto MD, Viapiana R y da Cruz Filho AM (2013). Assessment of the effectiveness of apple vinegar and its constituents for removing the smear layer and calcium ions from the root canal. International Journal of Research and Developement, 3:108-114.
44. Zehnder M, Kosicki D, Luder H, Sener B, Waltimo T (2002). Tissue dissolving capacity and antimicrobial effect of buffer and unbuffered hypochlorite solutions. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics, 94:756-62.





