Revista Canal Abierto 38 | Trabajo Científico Ganador
PRIMER LUGAR: Análisis de las modificaciones histológicas en la vascularidad de la pulpa dental humana durante su diferenciación, maduración y envejecimiento.
Dr. Claudio F. Boiero 1 Dr. Omar A. Gani 1
- Profesor de la Cátedra de Endodoncia Facultad de Odontología de la Universidad Nacional de Córdoba y de la Universidad Católica Córdoba.
- Profesor emérito de la Facultad de Odontología de la Universidad Nacional de Córdoba
Resumen
El sistema microvascular está constituido por arteriolas, capilares y vénulas y tiene como función realizar en los tejidos el intercambio de oxígeno, dióxido de carbono, agua, sales, nutrientes, metabolitos, etc., actividad que se cumple sobre todo en la zona del dominio capilar.
Además de otros cambios reportados, con la edad se produce una reducción gradual de la celularidad, el número de nervios y vasos sanguíneos.
Teniendo en cuenta que la circulación pulpar posee características que son propias de las terminales, es probable que, a raíz de estos cambios, las estructuras vasculares adquieran aspectos particulares que influirían en la función de la pulpa y en la evolución de sus procesos patológicos.
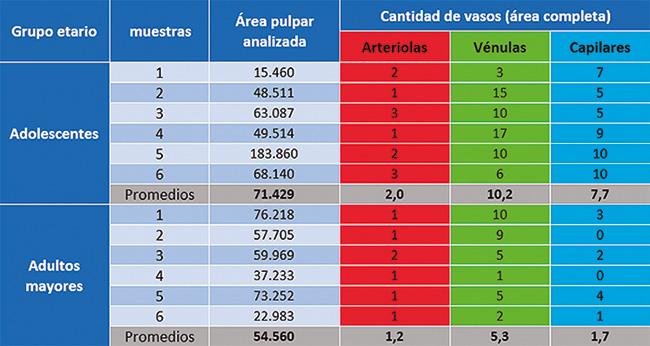
Por tal motivo, se diseñó el presente estudio, considerando las modificaciones histológicas que se producen durante las etapas de diferenciación, maduración y envejecimiento del tejido pulpar, en dientes ex vivo con pulpa dental sana y en dos grupos etarios (adolescentes y adultos mayores). El estudio consideró además de la variable edad, la diferenciación de arteriolas, vénulas y capilares, su número y distribución con relación al área de tejido pulpar del sector apical.
Los resultados mostraron que el método es viable y que el número de vasos disminuye significativamente con la edad y a expensas sobre todo de capilares y vénulas.
Introdución
El sistema microvascular está constituido por arteriolas, capilares y vénulas y tiene como función realizar en los tejidos el intercambio de oxígeno, dióxido de carbono, agua, sales, nutrientes, metabolitos, etc., actividad que se cumple sobre todo en la zona del dominio capilar.
La sangre llega a la cavidad pulpar mediante arteriolas que ingresan por el foramen apical o por foraminas accesorias, en compañía del paquete de nervios. Las arteriolas suben por la porción central de la pulpa radicular y se ramifican a manera de abanico para formar el plexo capilar subodontoblástico. Desde allí la circulación inicia su retorno mediante vénulas post-capilares y luego por vénulas de mayor calibre.
La continua formación de dentina secundaria a lo largo de la vida, reduce gradualmente el tamaño de la cámara pulpar y de los conductos radiculares. Además, ciertos cambios regresivos que se producen en la pulpa parecieran estar relacionados con el proceso de envejecimiento.
Con la edad se produciría una reducción gradual de la celularidad, el número de nervios y vasos sanguíneos, además de cambios en las estructuras vasculares pulpares como las dimensiones luminares y grosor de sus paredes.
Teniendo en cuenta que la circulación pulpar posee características que son propias de las terminales, es probable que, a raíz de estos cambios, las estructuras vasculares adquieran aspectos particulares que influirían en la función de la pulpa y en la evolución de sus procesos patológicos.
DESARROLLO
Se utilizaron dientes humanos recién extraídos de pacientes de dos rangos etarios (adolescentes de 14 a 20 años y adultos mayores de más de 50 años), que, en el momento del acto quirúrgico, presentaban buen estado de salud general y sin enfermedad periodontal y carecer de sintomatología pulpar. Los dientes utilizados fueron extraídos fundamentalmente por razones ortodóncicas, protéticas y mala posición y los pacientes y/o responsables adultos firmaron el consentimiento informado pertinente, según las normas vigentes del ejercicio profesional y comités de bioética. Inmediatamente de la exodoncia, se realizaron maniobras de identificación, acondicionamiento, fijación tisular por inmersión (solución de formol neutro al 10% buffer de fosfato a pH 7.4) y conformación y distribución de la muestra en dos grupos etarios de 6 órganos dentarios cada uno:
- Grupo 1: Adolescentes (de 14 a 20 años con ápice formado).
- Grupo 2: Adultos Mayores (más de 50 años).
Cada caso fue sometido a procesos de descalcificación lenta (solución de EDTA neutralizado con hidróxido de sodio).
Una vez lograda la decalcificación se procesaron histológicamente (inclusión y cortes, coloraciones HE, Tricrómica Cason).
Los preparados fueron observados con microscopio óptico (Olympus BX 50 Japón) a diferentes aumentos, y capturaron imágenes (cámara digital Sony C370P Japón) para su procesamiento y análisis con software analizador de imágenes ProPlus versión 4.5. Las estructuras vasculares observadas se diferenciaron e identificaron en arteriolas, vénulas y capilares, teniendo como criterio las características histológicas como por ejemplo, tamaño, forma, paredes vasculares y reactividad a las tinciones efectuadas.
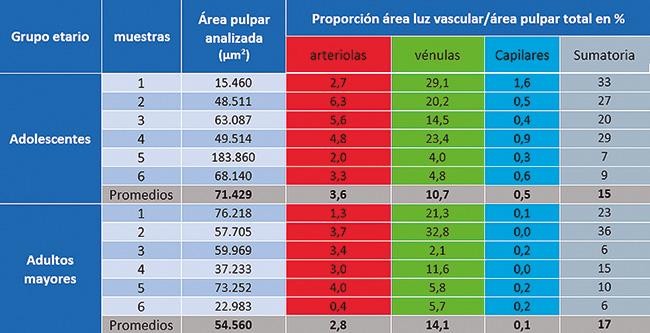
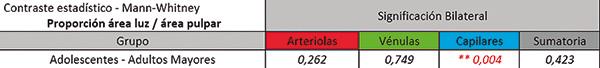
Sobre estas estructuras consideradas de interés, en cada una de ellas se obtuvieron distintas mediciones, pero en este estudio focalizado en el área total de pulpa analizada y número de vasos para determinar la proporción del área de la luz vascular en relación al área pulpar analizada. Los datos numéricos obtenidos se registraron en planillas de cálculo Microsoft Excel ® para realizar posteriormente el tratamiento estadístico, mediante el método de Mann – Whitney para contraste entre grupos y prueba T para la igualdad de medias, estableciéndose como nivel de significación p<0.05.
Resultados
El Grupo Adolescentes se caracterizó por presentar gran cantidad de vasos, con una llamativa disparidad en sus tamaños y variedad en las formas.
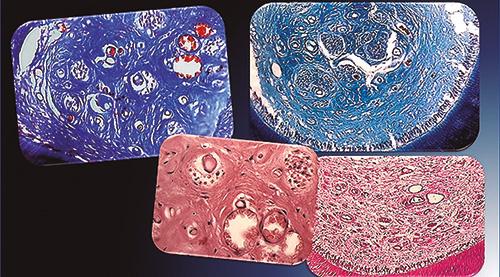
Imagen 1.
En el grupo de Adultos Mayores sobresalió una clara disminución en el número de los vasos y sobre todo una cierta uniformidad en todos los casos, en cuanto al número y tamaño.
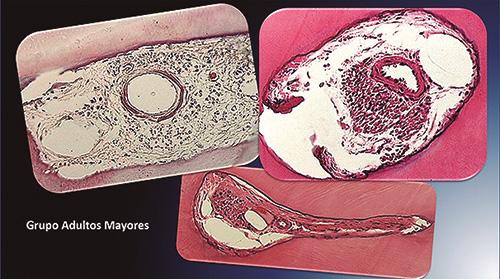
Imagen 2.
Número de arteriolas, vénulas y capilares
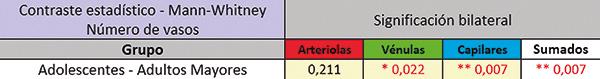
El tratamiento estadístico de los datos obtenidos mediante el test de Mann – Whitney mostró que los vasos sanguíneos pulpares del sector apical experimentan una significativa disminución con el envejecimiento y tal diferencia sería a expensas sobre todo en el número de capilares y vénulas.
Al considerar el área luminal total en relación al área pulpar analizada, se encontraron valores que se describen a continuación y su correspondiente representación gráfica de esta variable analizada en cada grupo etario donde el contraste estadístico entre los grupos no mostró diferencias estadísticas significativas en la suma total de vasos, con excepción de los capilares.
Caption
Caption
Porcentajes de área luminal de arteriolas, vénulas y capilares, con relación al área pulpar total analizada
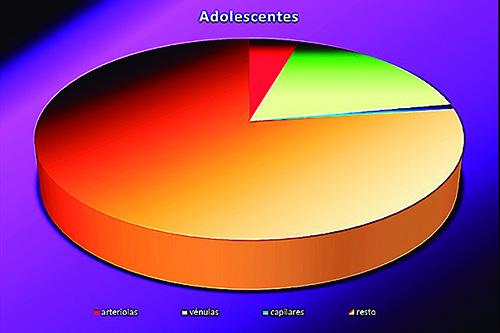
Gráfico 1 adolescentes.
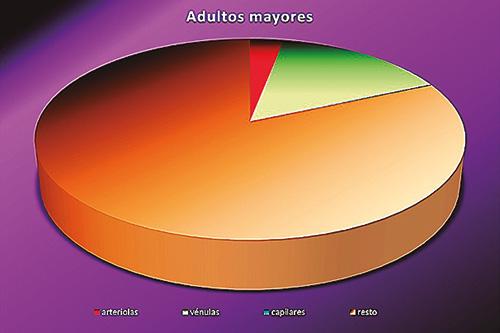
Gráfico 2 mayores.
Discusión
El estudio de la vascularización pulpar en humanos constituye un verdadero desafío, tanto por la naturaleza misma del tejido como por su particular situación de encierro, semejante al de la médula ósea.
Las características estructurales y el número de vasos quizás, sean lo primero que se debe considerar en un estudio de esta naturaleza.
El análisis estructural de la pared de los vasos permitió no sólo identificar las arteriolas y diferenciarlas de las vénulas y capilares, sino también, establecer cuántos de ellos era posible contar en la superficie pulpar analizada de cada sección transversal del conducto.
A este respecto, CHENG y PROVENZA (1959), estudiaron tanto en perros como en humanos, aspectos histomorfológicos de los vasos pulpares, como también las características de sus paredes y la amplitud de sus luces, y pudieron diferenciar arteriolas de vénulas, dejando en claro que las paredes de los vasos arteriales eran más gruesas y sus luces menores que las de las vénulas, las cuales, por lo tanto, las superaban en diámetro.
En nuestro trabajo, la presencia de una única arteriola predominó en los ambos grupos etarios, con promedios que oscilaron entre 1.2 y 2.00 arteriolas. Lo que no podemos saber es si estos vasos ingresaron al conducto por uno, dos o más forámenes, o si el tronco vascular inicial fue único en su ingreso al conducto, para de inmediato sufrir una bi o trifurcación, ya que en este estudio, los cortes se iniciaron a 2 mm del ápice radicular.
Situación muy distinta fue la de las vénulas, ya que sin duda su número fue mayor que el de las arteriolas. Es probable que en estos números estén incluidos algunos vasos linfáticos, ya que, tal como lo dice COHEN y BURNS (2002), no es fácil distinguirlos de las vénulas mediante técnicas convencionales para microscopía óptica.
Respecto de los capilares pudimos observar que éstos disminuyen notoriamente con la edad, al punto de que las diferencias fueron estadísticamente significativas entre los grupos de adolescentes y adultos mayores (p=0.007).
También, y siguiendo el análisis referido al número de vasos, realizamos la contrastación entre los grupos, pero considerando la sumatoria de arteriolas, vénulas y capilares, encontramos que las diferencias entre los dos grupos etarios considerados fueron estadísticamente significativas (p=0.007). Por lo tanto, se pone en evidencia que la edad ejercería una influencia muy marcada sobre la reducción del número de vénulas y capilares en el sector de la pulpa apical, como una obvia manifestación del envejecimiento, ya que tales diferencias fueron más evidentes en el grupo de adultos mayores respecto de los adolescentes.
Respecto del número de arteriolas, vénulas y capilares, no hemos encontrado trabajos donde se analice separadamente cada tipo de vasos y tampoco que se refieran específicamente a su número. Los autores que de alguna manera mencionan la cantidad de vasos, lo hacen sin considerar la edad y menos aún el sector apical del conducto.
En SAUNDERS, señalaba que en el sector apical de la pulpa existía un vaso de reducida luz que aumentaba gradualmente hacia el centro de la misma, donde había una mayor cantidad de vasos mayores. KRAMER (1960) observó en pulpas humanas perfundidas con tinta china, que luego de pasar por el foramen, los vasos se dirigían hacia la corona, al tiempo que emitían ramificaciones que se dividían y subdividían para formar el plexo capilar subodontoblástico, mas no cuantifican el número de vasos en el sector apical o central de la pulpa. En cuanto a las generalidades del sistema circulatorio de la pulpa, SELTZER y BENDER (1970) señalaban que una sola arteria o varios vasos pequeños penetraban por el agujero apical o por otros orificios adyacentes. Otros autores, como BERNICK y NEDELMAN (1975) se refirieron a la disminución en el número de vasos de la pulpa por razones de edad, pero sin establecer valores, y que esta disminución sería el resultado de calcificaciones de los vasos sanguíneos y nervios sobre todo a nivel de la pulpa coronaria.
Aun cuando estos autores no dan valores concretos en cuanto al número de vasos aferentes y eferentes de la pulpa, dejan aclarado que las estructuras vasculares se reducen con la edad, aspecto con el cual nuestros resultados coinciden totalmente. Concuerdan también, con el número de troncos arteriolares, ya que en todos los grupos etarios describen un reducido número de arteriolas, como así también, una paulatina disminución en su número. Respecto de los troncos venosos, concluyeron que éstos disminuyen con la edad y a medida que se acercan al foramen apical, informando además que el tamaño de las vénulas superaba al de las arteriolas.
El motivo por el cual las investigaciones en pulpa dental generalmente se refieren a su porción coronaria, podrían estar fundados en el hecho fisiopatológico mismo, ya que es la región coronaria donde se producen muchas reacciones fisiológicas y patológicas defensivas, por ser la porción del diente que más rápidamente se expone al ataque de las noxas, sean éstas bacterianas, físicas, químicas o mecánicas.
Sin embargo, sin el aporte sanguíneo que la pulpa recibe a través de los vasos apicales, ninguno de estos procesos de dentinificación podrían llevarse a cabo. De ello se deduce que los estudios sobre aspectos morfológicos, funcionales y aun patológicos de la pulpa, no se deberían circunscribir sólo al sector coronario como habitualmente se hace; deberían también ser realizados en el sector apical, donde existe un fisiologismo muy particular que difiere totalmente de aquel, y muchas veces está asociado a trastornos traumáticos que pueden tener consecuencias sobre circulación pulpar.
Analizando el área ocupada por arteriolas, vénulas y capilares con relación al total del área estudiada, y basados en los resultados obtenidos en el presente trabajo, resulta claro que se manifiesta una disminución del área vascularizada, lo que nos hace suponer que tales proporciones que se vieron significativamente disminuidas en el grupo de adultos mayores, respecto de los adolescentes, tendría una directa relación con el suministro de sangre, sugiriendo que la circulación pulpar humana disminuye, fundamentalmente, en pacientes adultos mayores.
A partir de los resultados obtenidos en este estudio, y en referencia a la proporción obtenida de la sumatoria de las áreas de la luz vascular en relación al área pulpar, se podría interpretar que los dientes de los adolescentes poseen mayor superficie ocupada por vasos sanguíneos a nivel apical que los adultos mayores (12% y 17%, respectivamente).
En consecuencia, la vascularización pulpar en la porción radicular y apical especialmente, adquiere una importancia relevante en el fisiologismo de la pulpa y del diente y, que sin duda guarda estrecha relación con la edad del paciente, aspecto que tendría que ser muy tenido en cuenta al momento de planificar un tratamiento odontológico conservador de la pulpa dental, en total acuerdo con lo sugerido por WALTON y col (1997).
Los requerimientos fisiológicos de esta zona apical hacen que no solo sea necesario tener en cuenta la relación que ésta guarda con tales necesidades, más importantes a temprana edad, sino también con los procesos patológicos que pueden afectar la integridad funcional de las estructuras vasculares. (BISHOP y MALHOTRA 1990; MARCHETTI y col 1990, 1991, MATSUMOTO y col. 1997, SAWA y col 1998).
La diferenciación, maduración y envejecimiento son parte de un proceso natural y fisiológico, por ende el diente no puede apartarse de los fenómenos que pueden acontecer por el paso del tiempo.
El consenso pareciera ser una constante cuando se habla de la reducción de la celularidad y aumento de fibras y otros tipos de degeneraciones en la propia pulpa y también cambios en los propios vasos sanguíneos (DOMINE y HOLZ, 1991).
Las estructuras calcificadas del diente que encierran a la pulpa, también sufren cambios con el paso del tiempo que se traducen en las respuestas fisiológicas a los estímulos externos, en la disminución de la permeabilidad dentinaria, en la obstrucción de túbulos, modificación de la dureza de la dentina, y esto sin duda tendrá implicancia en la dinámica del suministro sanguíneo, sea por efecto sobre las estructuras vasculares propiamente dichas o sobre el dinamismo del flujo sanguíneo (MURRAY y col 2002).
Profundizar los estudios referidos a las estructuras vasculares y su vinculación con la fisiología en la pulpa dental, asociándolos a los procesos de maduración y envejecimiento, constituyen un desafío y, sin duda, el punto de partida para futuras investigaciones tendientes a dar respuesta a los requerimientos clínicos, preferentemente en pacientes niños y adolescentes, donde el grado de inmadurez de la cavidad pulpar es tal, que la conservación de la pulpa en plena actividad funcional se transforma en una exigencia básica para que el diente alcance su desarrollo definitivo, y sobre todo, para indagar sobre la posible aplicación de terapéuticas sencillas que eviten la pérdida temprana de piezas dentarias.
Conclusión
El estudio histológico de los vasos pulpares del sector apical de la raíz permitió analizar, valorar y diferenciar distintos aspectos estructurales de la red vascular tanto en arteriolas, vénulas y capilares.
El número de arteriolas detectado en el sector apical de la pulpa dental, mostró una paulatina disminución con la edad. Las vénulas, en número mayor que el de las arteriolas, y también los capilares, mostraron la misma tendencia. Comparando entre grupos etarios la totalidad de los vasos (arteriolas, vénulas y capilares), las diferencias fueron significativas entre el grupo de adolescentes y adultos mayores, sobre todo a expensas de las vénulas y los capilares.
El área vascular de las arteriolas medida en secciones transversales de los vasos, mantuvo en los grupos etarios estudiados cierta regularidad en sus dimensiones. A pesar de manifestar diferencias en los valores, ellas carecieron de significación. El aumento en las dimensiones de vénulas que se manifiesta con el envejecimiento, fue significativo en los Adolescentes respecto a Adultos Mayores. 7.
El envejecimiento del sistema vascular de la pulpa a nivel del sector apical, parecería manifestarse, particularmente, en la disminución en el número de vasos y en el aumento del espesor de sus paredes
La alta variabilidad en los cambios numéricos e histomorfométricos que a consecuencia de la edad ocurren en los vasos de la pulpa y las implicancias que tales cambios podrían tener sobre el fisiologismo pulpar, requiere de estudios más profundos.
Referencias Bibliográficas
1. ABRASS CK, ADCOX MJ, AND RAUGI GJ (1995) Aging-associated changes in renal extracellular-matrix. Am J Pathol;146(3): 742-752.
2. ARTESE LUCIANO, RUBINI CORRADO, FERRERO GIUSEPPINA, FIORONI MASSIMILIANO, SANTINELLI ALFREDO y PIATTELLI ADRIANO (2002) Vascular endothelial growth factor (vegf) expression in healthy and inflamed human dental pulps. Journal of Endodontics vol. 28- Nº 1.
3. BARASSA A, DAZIA S, CANAVESE B, MODICA R (1981) Structure and vascularization of the dental pulp in horse incisors. Bull Assoc Anat (Nancy) Dec 65:367-81.
4. BENNET C.G, KELLN E.E, and BIDDINGTON W.R (1965) Age changes of the vascular pattern of the human dental pulp”. Arch Oral Biol 10, 995-98.
5. BERNICK S, NEDELMAN C (1975) Effects of aging on the human dental pulp. Journal of Endodontics 1 : 88.
6. BERNICK SOL(1977) Morphological changes to lymphatic vessels in pulpal inflammation J DENT RES 56(7):841-49
7. BRADLEY J.C (1972) Age changes in the vascular supply of the mandibule”. British Dental Journal, Feb 132 pp 142.
8. BURKE F, SAMARAWICKRAMA D (1995) Progressive changes in the pulpal-dentinal complex and their clinical consequences. Gerodontology 12, 57-66.
9. CASTELLI W, NNAJLETI C, DIAZ PEREZ R (1975) Interruption of the arterial inferior alveolar flow and its effects on mandibular collateral circulation and dental tissues. Journal Dental Research vol. 54 N*4 Jul-Aug pp 708-15.
10. COHEN B I, BURNS RC (2002) Vías de la Pulpa Harcourt España Ediciones. Madrid España. 8ª Edición paginas 405 y 565.
11. DOMINE L, HOLZ J (1991) The aging of the human pulp-dentin organ. Schweiz Monatsschr Zahnmed 101:725-33.
12. ESPINA A, CASTELLANOS A, VALERO C, ANEZ L (2000) Estudio submicroscópico del endotelio capilar de pulpa dental humana en jóvenes y viejos. Journal Dental Research 79 (5) Div. Venezuela Nº 33 pp 1335.
13. FINN GENNESER (2000) Histología 3ª Edición Sistema Microvascular capítulo 15 pp 381.
14. IIJIMA TADAHIKO y ZHANG JING-QI (2002). Three – dimensional wall structure and the innervation of dental pulp blood vessels. Microscopy Research and Technique 56:32-41
15. INGLE J L, TAINTOR J F (1987) Endodoncia Nueva Editorial Interamericana México DF 3ª Edición pp. 331.
16. KETTLER W (1983) Age-induced changes in the teeth and their attachment apparatus. Journal of Dental Research 33, 262-71.
17. KISHI Y, SHIMOZATO N, TAKAHASHI K (1989) Vascular architecture of cat pulp using corrosive resin cast under scanning electron microscope. Journal of Endodontics 15, 478-83.
18. KIM S, DÖRSCHER-KIM J E, LIU M, GRAYSON A (1990) Hemodynamic regulation of the dental pulp in a low compliance environment Journal of Endodontics Volume 16, Issue 2, 47-107.
19. KRAMER I.R.H (1960) The vascular arquitecture of human dental pulp. Arch Oral Biol vol.2 p. 177-189.
20. LOEVSCHALL H, FEJERSKOV O, JOSEPHSEN K (2000) Hitological changes age-related in pulp of molar wistar rats. Journal Dental Research 79 (5) pp 1295 Nº 47 Div. Escandinavia.
21. MATTHEWS B, ANDREW D (1995) Microvascular architecture and exchange in teeth. Microcirculation Dec 2 : 305-13.
22. MURRAY P, STANLEY HAROL R (2002) Age-related odontometric changes of human teeth Oral Surg Oral Med Oral Pathol Oral Radiol Endod 93:474 – 82.
23. OLGART L (1996) Neural control of pulpal blood flow. Crit Rev Oral Biol Med 7 (2) : 159-171 .
24. OEHMKE MATTHIAS J, KNOLLE ERICH y OEHMKE HANS JOACHIM (2003) Lymph drainage in the human dental pulp Microscopy Research and Technique vol 62: 187-191
25. PASHLEY D.H (1996) Dynamics of the dentin-pulpar complex. Crit Rev Oral Biol Med 7(2):104-133
26. PINZON R, KOZLOV M, BURCH W (1967) Histology of rat molar pulp at different ages. Journal Dental Research vol.46 Nº 1 Jan-Feb pp 202.
27. POLVERINI P.J (1995) The pathophysiology of angiogenesis. Crit Rev Oral Biol Med 6 (3) : 230-247.
28. RODD HD, BOISSONADE FM. (2005) Vascular status in human primary and permanent teeth in health and disease. Eur J Oral Sci vol 113 (2): 128–34
29. SAMAR M E, SVILS R, ESTEBAN RUIZ F J (2000) Técnicas histológicas. Fundamentos y aplicaciones. Editor Seis-C Impresiones. Córdoba Argentina.
30. SAWA Y, YOSHIDA S, ASHIKAGA Y, KIM T, YAMAOKA Y, SUZUKI M (1998) Inmunohistochemical demostration of lymphatic vessels in human dental pulp. Tissue Cell 510-6 Issue 5.
31. SELTZER Y BENDER (2002) Dental Pulp Quintessence Publishing Co, Inc. 3ª Edición pp. 123.
32. SEMBA I (1989) A histometrical analysis of age changes in the human lingual artery. Arch Oral Biol 34(7):483-9.
33. SEMBA I, KEISUKE F, MOOT K (2001) Histomorphometric analysis of age changes in the human inferior alveolar artery. Arch Oral Biol 46 13-21.
34. SOL BERNICK (1967) Age changes in the blood supply to human teeth. Journal Dental Research May-Jun vol.46 Nº3 p.p 544-50.
35. SOL BERNICK (1997) Morphological changes to lymphatic vessels in pulpal inflammation. Journal Dental Research 56 (7) : 841-849.
36. TAKAHASHI K (1990) Changes in the pulpal vasculature during inflammation. Journal of Endodontics 16, 92-7.
37. WALTON R (1997) Endodontics considerations in the geriatic patient. Dental Clinical of North America 41, 795-816.
38. YOSHIDA S, OHSHIMA H (1996) Distribution and organization of peripheral capillaries in dental pulp and their relationship to odontoblasts. Anat Rec 245(2):313-26
39. ZHANG JING QI, IIJIMA TADAHIKO Y TANAKA TERUO (1993) Scanning electron microscopic observation of the vascular wall cells in human dental pulp. Journal of Endodontic vol.19 Nº2 February





